Hemoglobina
| ||||||
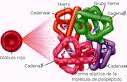
La Hemoglobina es una proteína contenida en los Eritrocitos que constituye, aproximadamente, el 35% de su peso y le da su color rojo característico además de su función de transportar el oxígeno y el dióxido de carbono en el proceso de la respiración celular.
Sumario
Definición
Es una cromoproteína (proteína conjugada), está presente en todos los animales, excepto en algunos grupos de animales inferiores y su función es el transporte de oxígeno y dióxido de carbono.
La cifras normales en el ser humano son de 12 a 16 g por 100 mL. La hemoglobina le confiere a los eritrocitos la función de transportar el oxígeno desde los pulmones hasta los tejidos, y parte del dióxido de carbono desde los tejidos hasta los pulmones, participa de esta manera en el proceso de la respiración. Además, como todas las proteínas, contribuye a mantener el equilibrio ácido-básico de la sangre al actuar como un sistema amortiguador del pH sanguíneo (sistema buffer o tampón).
Participa en el proceso de la respiración celular por el que la sangre lleva el oxígeno desde los pulmones (o desde las Branquias, en los peces), donde la sangre lo capta, hasta los tejidos y células del cuerpo y conduce el dióxido de carbono desde las células y tejidos hacia los pulmones para ser liberado al exterior y comenzar nuevamente el ciclo de la respiración.
Cuando la hemoglobina se une al oxígeno para ser transportada hacia los órganos del cuerpo, se llama oxihemoglobina, cuando se une al Dióxido de carbono (CO2) para ser eliminada por la espiración, que ocurre en los pulmones, recibe el nombre de desoxihemoglobina.
Si la hemoglobina se une al Monóxido de carbono (CO), se forma entonces un compuesto muy estable llamado Carboxihemoglobina, que tiene un enlace muy fuerte con el grupo hemo de la hemoglobina e impide la captación del oxígeno, con lo que se genera fácilmente una Anoxia que puede conducir a la muerte celular si fuera irreversible.
Composición
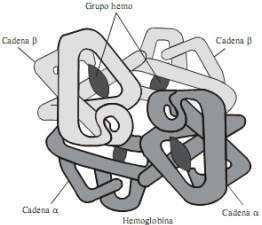
La molécula de hemoglobina está constituida por una porción proteica llamada globina (compuesta por 2 pares de cadenas polipeptídicas diferentes que contienen numerosos aminoácidos) y 4 grupos prostéticos nombrados “hem” en cuyo centro se localiza un átomo de hierro; de manera que la molécula de hemoglobina está formada por 4 subunidades, cada una de las cuales posee un grupo hemo unido a un polipéptido. Las variaciones en las cadenas polipeptídicas dan origen a diferentes tipos de hemoglobinas. Por ejemplo; las hemoglobinas normales del adulto (Hb A1 y A2), y la del feto (Hb F) que tiene gran afinidad por el oxígeno.
Sistema tampón de la Hemoglobina
El sistema tampón de la hemoglobina actúa solo en el eritrocito, pues es su principal sistema tampón y está muy ligado a la capacidad de disociación del oxígeno de la molécula de hemoglobina: cuando esta molécula se oxigena, se produce la liberación de hidrogeniones y cuando se desoxigena, se captan los hidrogeniones (por cada mol de oxígeno liberado, la hemoglobina capta 0,5 mol de H+). Por ello y por su condición de sustancia anfótera, cuando el pH sanguíneo se eleva (disminución de la concentración de Hidrogeniones [H+] en el medio), la hemoglobina tiende a liberar iones H+ y, por lo tanto, se altera la curva de disociación, existirá tendencia a retener el oxígeno y se producirá así un déficit de oxigenación de los tejidos.
Alteraciones de la Hemoglobina
Alteraciones genéticas de la molécula de Hb que se demuestran por cambios en las características químicas, en la movilidad electroforética o en otras propiedades físicas.
La molécula de Hb normal en el adulto (Hb A) consta de dos pares de cadenas polipeptídicas denominadas a y b. La Hb fetal (Hb F, en la que las cadenas g sustituyen a las cadenas b) disminuye gradualmente en los primeros meses de vida hasta que representa menos del 2% de la Hb total del adulto. En ciertos trastornos de la síntesis de Hb y en los estados aplásicos y mieloproliferativos, la Hb F puede estar aumentada. La sangre normal también contiene, como máximo, un 2,5% de Hb A2 (compuesta de cadenas a y d).
Los tipos de cadenas y la estructura química de sus polipéptidos están controlados genéticamente. Pueden aparecer defectos en las moléculas de Hb, con propiedades físicas o químicas anómalas; algunos provocan anemias que son graves en los individuos homocigotos, pero leves en los portadores heterocigotos. Algunas personas pueden ser heterocigotas para dos de estas anomalías y presentar una anemia con caracteríticas de ambos rasgos.
Las Hb anómalas, diferenciadas por su movilidad electroforética, se designan alfabéticamente en orden de descubrimiento (p. ej., A, B, C), si bien la primera de ellas, la Hb de las células falciformes, se denominó Hb S. Las Hb estructuralmente diferentes con la misma movilidad electroforética también se denominan según la ciudad donde se descubrieron (p. ej., Hb S Memphis, Hb C Harlem).
Hemoglobina S
También existen hemoglobinas anormales, las alteraciones de la estructura de la hemoglobina pueden ocasionar enfermedades. De éstas, la más importante es la Anemia de hematíes falciformes o anemia hemolítica congénita de células falciformes, llamada drepanocítica o sicklemia.
La hemoglobina S es producida debido a una mutación genética que afecta el gen que codifica para la síntesis de la cadena beta de la hemoglobina y conduce al reemplazo del aminoácido ácido glutámico por el aminoácido valina en la sexta posición de la cadena globínica beta, esta hemoglobina así alterada es capaz de deformar a los Eritrocitos y acelerar su hemolisis en condiciones de hipoxia tisular.
Como esta sustitución se lleva a cabo en una posición superficial de la molécula de hemoglobina y la carga eléctrica es diferente, la movilidad electroforética de la HbS es menor que la de la hemoglobina normal, pudiéndose ser fácilmente separada e identificada en la Electroforésis de Hemoglobina.
Hemoglobina Glicosilada
La Hemoglobina glicosilada (HbA1C) es el producto estable de la glucosilación no enzimática de la cadena b de la hemoglobina por la glucosa plasmática y se forma a velocidades que aumentan con los niveles crecientes de glucosa plasmática. Este estado de la hemoglobina hace que aumente su afinidad por el oxígeno y es dificil el intercambio de éste con las células y por tanto su función se ve afectada.
La mayoría de los médicos determinan periódicamente la hemoglobina glucosilada (HbA1C) para valorar el control de la glucosa plasmática durante el mes a los 3 meses precedentes. En la mayoría de los laboratorios, el nivel normal de HbA1C está entre 3.9 y 6.9%; en los diabéticos poco controlados el nivel oscila entre el 9 y el 12%. La determinación sérica de la HbA1C no es una prueba específica para diagnosticar la diabetes mellitus, sin embargo, una HbA1C elevada suele indicar la existencia de este síndrome.
Fuentes
- Rossell Puig W, Dovale Borjas C, Álvarez Torres I. Morfología Humana. la Habana. Editorial Ciencias Médicas, 2002. Tomo II. ISBN 959-7132-72-9
- Suardíaz J, Cruz C, Colina A y otros. Laboratorio Clínico. La Habana. Editorial Ciencias Médicas. 2004. ISBN 959-212-120-6