Proteína
| ||||||
Las proteínas son macromoléculas biológicas fundamentales compuestas por cadenas lineales de aminoácidos, unidas mediante enlaces peptídicos. Constituyen uno de los tres macronutrientes esenciales, junto con los carbohidratos y las grasas, y desempeñan roles críticos en prácticamente todos los procesos biológicos.
Sumario
- 1 Composición química y características generales
- 2 Estructura proteica
- 3 Clasificación de proteínas
- 4 Funciones biológicas
- 5 Metabolismo proteico
- 6 Requerimientos nutricionales
- 7 Desnaturalización proteica
- 8 Proteínas y salud
- 9 Métodos de estudio
- 10 Perspectivas y aplicaciones futuras
- 11 Véase también
- 12 Referencias
Composición química y características generales
Composición elemental
Las proteínas están compuestas principalmente por:
- Carbono (50-55 %)
- Hidrógeno (6-7 %)
- Oxígeno (19-24%)
- Nitrógeno (13-19 %)
- Azufre (0-4 %)
Adicionalmente, algunas proteínas pueden contener elementos como Fósforo, Hierro, Zinc y Cobre.
Propiedades fundamentales
- Elevada masa molecular: Desde aproximadamente 5.000 hasta varios millones de Daltons
- Carácter anfótero: Pueden actuar como ácidos o bases
- Especificidad estructural: Cada proteína posee una conformación tridimensional única
- Desnaturalización: Pérdida de estructura nativa por cambios de pH, temperatura u otros factores
Estructura proteica
La organización estructural de las proteínas se describe en cuatro niveles jerárquicos:
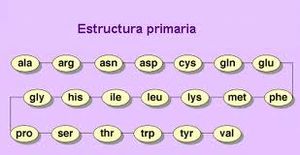
Estructura primaria
La estructura primaria consiste en la secuencia lineal de aminoácidos unidos por enlaces peptídicos. Esta secuencia está determinada genéticamente y define la identidad de la proteína.
Características principales:
- Secuencia específica de aminoácidos
- Determinada por el código genético
- Estabilidad conferida por enlaces covalentes
- Fundamento de la diversidad proteica
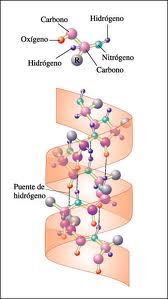
Estructura secundaria
La estructura secundaria se refiere a los plegamientos locales regulares de la cadena polipeptídica, estabilizados principalmente por puentes de hidrógeno.
Formas principales:
- a-hélice: Estructura helicoidal estabilizada por puentes de hidrógeno intracatenarios
- ß-lámina plegada: Estructura extendida con puentes de hidrógeno intercatenarios
- Giros ß: Cambios abruptos en la dirección de la cadena
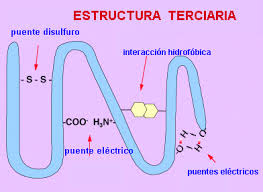
Estructura terciaria
La estructura terciaria representa el plegamiento tridimensional completo de una cadena polipeptídica, resultante de las interacciones entre los grupos R de los aminoácidos.
Fuerzas estabilizadoras:
- Enlaces de hidrógeno
- Interacciones hidrofóbicas
- Puentes salinos
- Enlaces disulfuro
- Fuerzas de van der Waals
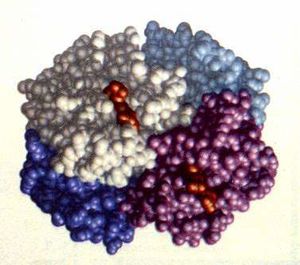
Estructura cuaternaria
La estructura cuaternaria describe la asociación de múltiples cadenas polipeptídicas (subunidades) para formar un complejo proteico funcional.
Ejemplos notables:
- Hemoglobina: 4 subunidades (2a y 2ß)
- Colágeno: 3 cadenas entrelazadas
- Insulina: 2 cadenas unidas por puentes disulfuro
Clasificación de proteínas
Por composición
| Tipo | Características | Ejemplos |
|---|---|---|
| Proteínas simples | Solo aminoácidos | Albúmina, globulinas |
| Proteínas conjugadas | Grupo prostético no proteico | Hemoglobina (hemo), lipoproteínas |
| Glicoproteínas | Carbohidratos unidos | Inmunoglobulinas, mucinas |
| Nucleoproteínas | Ácidos nucleicos | Ribosomas, cromatina |
Por forma y solubilidad
- Proteínas fibrosas: Estructuras alargadas, insolubles, función estructural (colágeno, queratina)
- Proteínas globulares: Forma esférica, solubles, función dinámica (enzimas, anticuerpos)
- Proteínas de membrana: Asociadas a bicapas lipídicas (receptores, transportadores)
Funciones biológicas
Función estructural
- Colágeno: Tejido conectivo, huesos, piel
- Queratina: Pelo, uñas, plumas
- Actina y miosina: Filamentos musculares
- Tubulina: Microtúbulos del citoesqueleto
Función catalítica
Las enzimas catalizan reacciones bioquímicas específicas:
- Aceleración de reacciones (106-10¹² veces)
- Especificidad de sustrato
- Regulación alostérica
Función de transporte
- Hemoglobina: Transporte de oxígeno
- Albúmina sérica: Transporte de ácidos grasos, hormonas
- Transferrina: Transporte de hierro
- Proteínas de membrana: Transporte a través de membranas
Función de defensa
- Inmunoglobulinas: Respuesta inmune adaptativa
- Complemento: Defensa innata
- Fibrinógeno: Coagulación sanguínea
- Interferones: Defensa antiviral
Función reguladora
- Hormonas proteicas: Insulina, glucagón, hormona del crecimiento
- Factores de transcripción: Regulación de la expresión génica
- Receptores: Transducción de señales
Función de reserva
- Ovoalbúmina: Clara de huevo
- Caseína: Leche
- Ferritina: Reserva de hierro
Metabolismo proteico
Digestión y absorción
Proceso que ocurre principalmente en el estómago e intestino delgado:
- Estómago: Pepsina (pH óptimo 1.5-2.5)
- Intestino delgado: Enzimas pancreáticas (tripsina, quimotripsina, carboxipeptidasas)
- Absorción: Aminoácidos y dipéptidos mediante transportadores específicos
Síntesis proteica
Proceso de traducción en los ribosomas:
- Iniciación: Unión del ribosoma al mRNA
- Elongación: Adición secuencial de aminoácidos
- Terminación: Liberación del polipéptido completo
- Plegamiento y procesamiento: Adquisición de la estructura nativa
Degradación y reciclaje
- Recambio proteico constante (1-2% por día en humanos)
- Proteasas intracelulares (proteosomas, lisosomas)
- Balance nitrogenado: Equilibrio entre síntesis y degradación
Requerimientos nutricionales
Ingesta recomendada
Según la FAO/OMS (2023):
- Adultos: 0.8 g/kg peso corporal/día
- Deportistas: 1.2-2.0 g/kg peso corporal/día
- Embarazo/lactancia: +25 g/día adicionales
- Niños: 1.5-1.8 g/kg peso corporal/día
Calidad proteica
Evaluada mediante:
- Valor biológico: Eficiencia de utilización
- Digestibilidad: Fracción absorbida
- Aminoácidos limitantes: Lisina (cereales), metionina (legumbres)
Fuentes alimentarias
- Origen animal: Carnes, pescados, huevos, lácteos (alto valor biológico)
- Origen vegetal: Legumbres, cereales, frutos secos (complementación proteica)
- Proteínas completas: Contienen todos los aminoácidos esenciales en proporciones adecuadas
Desnaturalización proteica
Mecanismos de desnaturalización
- Térmica: Calentamiento (cocción, pasteurización)
- Química: Cambios de pH, solventes orgánicos, detergentes
- Mecánica: Agitación, presión
- Radiactiva: Radiación UV, ionizante
Aplicaciones culinarias
- Coagulación: Huevos, quesos, flanes
- Gelificación: Gelatinas, postres
- Emulsificación: Mayonesas, salsas
- Espumificación: Merengues, mousses
Proteínas y salud
Enfermedades relacionadas
- Desnutrición proteico-calórica: Kwashiorkor, marasmo
- Errores innatos del metabolismo: Fenilcetonuria, enfermedad de maple syrup
- Enfermedades por plegamiento incorrecto: Enfermedad de Alzheimer, enfermedad de Creutzfeldt-Jakob
- Alergias alimentarias: Reacción a proteínas específicas
Aplicaciones terapéuticas
- Insulina: Diabetes mellitus
- Hormona de crecimiento: Enanismo hipofisario
- Factor VIII: Hemofilia A
- Terapias biológicas: Anticuerpos monoclonales
Métodos de estudio
Técnicas estructurales
- Cristalografía de rayos X: Determinación de estructura atómica
- RMN: Estructura en solución
- Microscopía crioelectrónica: Estructura de complejos macromoleculares
- Espectrometría de masas: Identificación y caracterización
Técnicas funcionales
- Ensayos enzimáticos: Actividad catalítica
- Inmunoensayos: Detección y cuantificación
- Técnicas de unión: Afinidad por ligandos
- Estudios de expresión: Niveles proteicos celulares
Perspectivas y aplicaciones futuras
Ingeniería de proteínas
- Diseño racional: Modificación de propiedades
- Evolución dirigida: Mejora de funciones
- Proteínas quiméricas: Combinación de dominios funcionales
Aplicaciones biotecnológicas
- Enzimas industriales: Detergentes, procesamiento de alimentos
- Biosensores: Detección de analitos
- Terapias avanzadas: Ingeniería de tejidos, liberación controlada de fármacos
Proteómica
Estudio a gran escala de:
- Expresión proteica bajo diferentes condiciones
- Modificaciones postraduccionales
- Interacciones proteína-proteína
- Biomarcadores de enfermedades
Véase también
- Traducción (genética)
- Ingeniería de proteínas
Referencias
Bibliografía fundamental
- Berg, J. M., Tymoczko, J. L., & Gatto, G. J. (2019). Bioquímica (9.ª ed.). Reverté.
- Nelson, D. L., & Cox, M. M. (2021). Lehninger Principles of Biochemistry (8.ª ed.). W.H. Freeman.
- Voet, D., Voet, J. G., & Pratt, C. W. (2016). Fundamentals of Biochemistry (5.ª ed.). Wiley.
Fuentes especializadas
- Córdova Frunz, J. L. (2006). La química y la cocina. Fondo de Cultura Económica.
- Zumbado Fernández, H. (2004). Análisis químico de los alimentos: métodos clásicos. Editorial Universitaria.
FAO/OMS (2023). Dietary Protein Quality Evaluation in Human Nutrition.
Lecturas recomendadas
- Branden, C., & Tooze, J. (1999). Introduction to Protein Structure (2.ª ed.). Garland Science.
- Creighton, T. E. (1993). Proteins: Structures and Molecular Properties (2.ª ed.). W.H. Freeman.