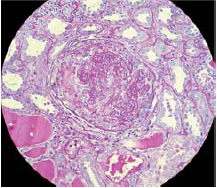
Glomerulonefritis rápidamente progresiva
Glomerulonefritis rápidamente progresiva (GRP). Es un síndrome con evolución rápida, con agresividad marcada y un individuo con función renal normal puede entrar en insuficiencia renal terminal en el transcurso de pocos días. Las formas de glomerulonefritis rápidamente progresivas se caracterizan clínicamente por un inicio agudo, con rápido deterioro de la función renal («rápidamente progresiva») y una lesión con la presencia de semilunas epiteliales en el 50 % o más de los glomérulos no esclerosados en la muestra de biopsia.
También se ha descrito como una glomerulonefritis proliferativa extracapilar con declinación rápida del filtrado glomerular, que puede observarse como una entidad idiopática (relacionada con anticuerpos antimembrana basal, o con inmunocomplejos, o sin ellos) o instalarse en otra glomerulopatía primaria o de una enfermedad sistémica.
Por la imagen histológica también ha recibido el nombre de glomerulonefritis crescéntica. Las semilunas están compuestas por células de aspecto epitelial, externa a la zona central del ovillo glomerular, motivo que justifica también la denominación de glomerulonefritis proliferativa extracapilar. La formación de semilunas puede aparecer en cualquier forma de glomerulonefritis proliferativa o de vasculitis renal como una respuesta glomerular inespecífica.
Por tal motivo, en este tema utilizaremos el criterio de glomerulonefritis rápidamente progresiva y trataremos de definir brevemente los diferentes tipos, que con distintos mecanismos inmunopatológicos y pronóstico, se presentan con esta forma clínico-histológica.
Sumario
Patología
El hallazgo patognomónico es la presencia de semilunas epiteliales dentro del espacio de Bowman, que comprimen y colapsan el ovillo glomerular. Se ha descrito la semiluna o creciente epitelial como un agregado de células, por lo menos de 2 capas de profundidad, que puede ocupar un pequeño o gran segmento del espacio de Bowman y que puede extenderse hasta obliterar el ovillo de capilares glomerulares.
Aunque se le sigue denominando semiluna o creciente epitelial, los estudios con anticuerpos monoclonales han demostrado que las células epiteliales son un componente menor de la semiluna y están constituidas principalmente por células de origen macrófago. Con frecuencia, también contiene eritrocitos, depósitos de fibrina y leucocitos polimorfonucleares; en ocasiones, está compuesta en su totalidad por células, y en otras contiene además tejido conectivo. La creciente fibrocelular está compuesta casi completamente por tejido fibroso. Finalmente en su proceso evolutivo, la creciente llega a esclerosarse.
Los hallazgos de la inmunofluorescencia son variables de acuerdo con el tipo de glomerulonefritis rápidamente progresiva, que como se señaló con anterioridad, solo constituye un síndrome. Las alteraciones inmunohistoquímicas se abordarán al analizar los 4 tipos principales.
Epidemiología
Las GRP pueden verse en niños y adultos y en cualquier lugar del planeta. En un estudio reciente en niños con insuficiencia renal realizado en Suecia y donde se incluyen 118 con insuficiencia renal crónica y 97 con insuficiencia renal terminal, apareció como causa la glomerulonefritis crescéntica en 4 y 3 niños, respectivamente.
En otro estudio realizado en España, se halló glomerulonefritis extracapilar en 0,9 % de los niños con síndrome nefrótico, y entre todas las biopsias realizadas se encontró en 1,1 %. En los adultos, entre todas las biopsias realizadas se observó en 5,2 % de los casos y en las glomerulopatías primarias apareció esta lesión en 9,5 %.
Los datos de North American Pediatric Renal Transplant Cooperative Study de 1994, 1995 y 1996, con un total de 8 505 casos con insuficiencia renal, reportan 134 (1,5 %) de glomerulonefritis crescéntica idiopática. En un estudio de 90 niños con insuficiencia renal realizado en Túnez, esta lesión se reporta en 3 casos (3,3 %).
En nuestro medio, se encontró esta forma clínico-histológica en 1 % de los síndromes nefríticos agudos del niño. En un estudio realizado en Colombia se encontró esta lesión en 8,1 % (31/383) de las biopsias y Muñoz Arizpe y colaboradores reportan esta glomerulonefritis en 56 niños en un estudio realizado durante 16 años.
De las GRP la mejor estudiada epidemiológicamente es la enfermedad por anticuerpos antiMBG. En grandes series se ha reportado esta variedad en 1 a 2 % de los pacientes; se reporta en todos los continentes, y parece ser menos frecuente en Asia y el Caribe; puede aparecer en edades extremas y los casos más joven y más viejo encontrados en la amplia revisión de Turner y colaboradores tenían 4 y 81 años, respectivamente. Con posterioridad, se ha encontrado el reporte de un niño de 2,5 años que parece ser el más joven publicado hasta la fecha. El pico de incidencia se observa en la tercera década de la vida. La relación por sexo señalada por Turner y colaboradores es de predominio masculino con una relación algo menor de 2:1.
Se han reportado casos de enfermedad antiMBG después de litotricia y obstrucción ureteral, sugiriendo que el antígeno liberado por un riñón dañado mecánicamente puede iniciar la enfermedad en individuos susceptibles.
Clasificación
La mayoría de las GRP o extracapilares son de causa desconocida. Puede aparecer de «novo» o complicando enfermedades glomerulares específicas. La clasificación se basa en los datos aportados por la determinación en suero de parámetros inmunológicos, y los brindados por la inmunofluorescencia directa. Los datos inmunológicos más importantes son los anticuerpos antiMBG y los anticuerpos contra ciertos antígenos del citoplasma de los neutrófilos (ANCA). Se describen 4 tipos que tienen rasgos comunes, con mecanismos patogénicos diferentes y algunas características clínicas propias. En el cuadro 139.9 se presentan las variantes que describe Rivera.
Glomerulonefritis rápidamente progresiva tipo I
Goodpasture fue el primero en describir la combinación de hemorragia pulmonar y glomerulonefritis. Actualmente se sabe que este complejo síndrome puede producirse por diferentes causas y el término síndrome de Goodpasture se restringe a una entidad fisiopatológica específica, que, por lo general, se presenta en hombres jóvenes y en la que se encuentran anticuerpos antiMBG circulantes. Estos anticuerpos también reaccionan con su antígeno similar en pulmón produciendo una alveolitis con hemorragia pulmonar. Por lo general, la hemorragia precede a las manifestaciones clínicas de enfermedad renal, aunque algunos pacientes solo tienen afectación nefrológica. Por tal motivo, se ha sugerido que debe haber alguna alteración pulmonar concurrente que permita que los anticuerpos puedan pasar al alveolo, y se citan la influenza, la inhalación de hidrocarburos y los fumadores crónicos, como predisponentes.
La característica nefrológica clínica es una insuficiencia renal aguda progresiva con sedimento urinario de un síndrome nefrítico agudo. La proteinuria, por lo general, es ligera y casi siempre falta el edema. La microscopia óptica muestra una glomerulonefritis proliferativa necrotizante con formación de semilunas en más del 50 % de los glomérulos. En la inmunofluorescencia se observan depósitos lineales de IgG y C3 en la MBG. Hallazgos similares pueden verse en los alveolos afectados.
Esta forma de glomerulonefritis rápidamente progresiva constituye solo el 6 % de los casos de este síndrome y, por lo general, se presenta en adultos. Es muy infrecuente en el niño.
Glomerulonefritis rápidamente progresiva tipo II
Esta forma de glomerulonefritis rápidamente progresiva, mediada por inmunocomplejos en la mayoría de los casos está asociada a enfermedades sistémicas como lupus eritematoso sistémico, púrpura anafilactoide, endocarditis bacteriana subaguda o derivación ventriculoatrial infectada y crioglobulinemia mixta. También puede sobreañadirse a ciertas glomerulopatías primarias. En ocasiones, no hay ninguna causa subyacente conocida y se le considera idiopática. Sus manifestaciones clínicas son similares a las del tipo I.
La microscopia óptica también muestra una imagen similar a la anterior. La inmunofluorescencia directa demuestra depósitos granulares de inmunoglobulinas y complemento en el mesangio y otras áreas del ovillo glomerular y el microscopio electrónico detecta áreas electrodensas que indican la presencia de inmunocomplejos.
El tipo II constituye aproximadamente el 20 % de todas las glomerulonefritis rápidamente progresivas. Es la forma más frecuente en el niño.
Glomerulonefritis rápidamente progresiva tipo III
Esta forma, también llamada pauciinmune, sin depósitos de material inmune en el glomérulo, por lo general tiene anticuerpos contra el citoplasma de los neutrófilos (ANCA), indicando que forma parte de una vasculitis.
La microscopia óptica muestra zonas de necrosis segmentaria; la inmunofluorescencia directa es negativa y el estudio con microscopia electrónica es inespecífico, sin depósitos electrodensos.
Esta forma constituye el 70 % de las glomerulonefritis rápidamente progresivas y predomina en adultos y ancianos del sexo masculino. Aquellos casos con ANCA dirigidos contra proteinasa-3 por lo general tienen granulomatosis de Wegener y los que tienen anticuerpos antimieloperoxidasa lo más probable es que tengan una poliangeitis microscópica.
Glomerulonefritis rápidamente progresiva tipo IV
También conocida como forma mixta (tipo I y tipo III) es la menos frecuente de todas. Solo se reporta en aproximadamente 4 % de los casos y predomina en edades avanzadas y sexo femenino.
Etiopatogenia
Como se señaló anteriormente los mecanismos inmunopatogénicos son diferentes en los 4 tipos de glomerulonefritis rápidamente progresiva, por lo que se revisarán brevemente. Todos los tipos de lesión que desencadena la formación de semilunas se deben a la rotura de la pared capilar que permite el paso de fibrinógeno y de monocitos al espacio de Bowman. Según Rivera la secuencia patogénica aproximada es la siguiente:
- Depósitos de anticuerpos, complejos inmunes y de complemento que lesionan la pared capilar.
- Paso de fibrinógeno y fibronectina al espacio urinario.
- Atracción de monocitos circulantes.
- Proliferación de células epiteliales de la cápsula de Bowman.
- Aumento de la síntesis de proteínas matriciales con formación de semilunas.
- Evolución hacia la fibrosis, por aumento de la síntesis de colágeno e infiltración de fibroblastos.
Las diferencias son las siguientes:
- En el tipo I, la patogenia está mediada por anticuerpos antiMBG.
- El tipo II, por lo general se asocia a enfermedades sistémicas.
- El tipo III, corresponde a una vasculitis con ANCA circulante en 75 a 90 % de los casos.
- En el tipo IV, hay doble mecanismo, con anticuerpos antiMBG y ANCA. Los ANCA lesionan las células endoteliales, generando antígenos que estimulan la producción de anticuepos antiMBG.
Manifestaciones clínicas
Por lo general se presenta como un síndrome nefrítico agudo que evoluciona con insuficiencia renal progresiva o con un síndrome nefrótico con retención de azoados.
Al revisar 3 importantes series de GNRP en el niño, los síntomas y signos más frecuentes son: proteinuria moderada o severa en 88 %, hematuria macroscópica en 82 %, hipertensión arterial en 74 %, hipocomplementemia en 71 %, edema en 47 % y oliguria en 18 % de los casos.
Alteraciones de laboratorio: Las alteraciones de laboratorio se pueden dividir en generales del síndrome y específicas de cada tipo de glomerulopatía.
Generales: Proteinuria ligera, moderada o severa, hematuria macroscópica o microscópica con hematíes dismórficos y cilindros granulosos y eritrocitarios. El ultrasonido puede mostrar riñones hiperecogénicos con pobre delimitación corticomedular, pero de tamaño normal.
La creatinina se corresponderá con el grado de insuficiencia renal.
Específicas: En el tipo I se detectarán anticuerpos antiMBG; en el tipo II puede haber hipocomplementemia e inmunocomplejos circulanntes; en las restantes habrá normocomplementemia. En el tipo III se demostrará ANCA en 30 a 90 % de los casos y anticuerpos antiMBG en 30 %, aproximadamente. En el tipo IV se encontrará ANCA en un alto porcentaje de pacientes.
Diagnóstico
El diagnóstico se establece mediante la biopsia renal que demuestra más del 50 % de glomérulos con crecientes epiteliales en un paciente con insuficiencia renal aguda. Para diferenciar los distintos tipos es necesario recurrir a pruebas específicas de laboratorio.
Tratamiento
Se han utilizado muchos tratamientos y sus resultados son muy discutidos. Debido a la rareza de estas glomerulonefritis no hay estudios controlados con tratamiento y sin él. En sentido general el tratamiento puede ser:
Esteroides: Metilprednisolona: 30 mg/kg/día sin pasar de 1 g diario durante 3 días consecutivos, seguidos por prednisona: 60 mg/m2/día durante 4 semanas y después ir reduciendo la dosis. En el tipo II (vasculitis), se recomienda una dosis más baja de metilprednisolona (7 mg/kg/día).
Ciclofosfamida: Se pueden utilizar 2 formas de administración:
_ Por vía oral, 2 mg/kg/día durante 6 a 8 meses. Después de 6 meses se puede sustituir por azatioprina.
_ Pulsos intravenosos de 0,75 a 1 g/m2, sin pasar de l g cada 28 a 30 días, por lo menos durante 6 meses. Actualmente es la forma más recomendada y utilizada.
En los casos tipo I se asocia la plasmaféresis en sesiones diarias o en días alternos.
En cualquiera de los casos, si al cabo de 2 semanas con este tratamiento intensivo no se obtiene mejoría de la función renal debe valorarse el tratamiento sustitutivo con diálisis, ya que continuar la inmunosupresión tiene más riesgos que beneficios.
No debe realizarse trasplante renal con anticuerpos antiMBG positivos, mientras que la presencia de ANCA no está bien definida, pero la positividad no parece incrementar el riesgo de recurrencia.
Fuentes
- Temas de Medicina Interna. Tomo 2. 4ta. Edición. La Habana, 2002
- es.wikipedia.org
- scuela.med.puc.cl