Babesia
| ||||||||||||||||
Sumario
Historia
El protozoo responsable de la fiebre de Texas en el ganado fue primero identificado en 1888 por el biólogo rumano Victor Babeş, en honor del cual se denominan el género del microorganismo y la enfermedad que causa. El primer caso documentado en humanos no se produjo hasta 1957 en la antigua Yugoslavia.Entre 1982 y 2001 se ha informado de 200 casos de Babesia microti en los EE.UU.
Especies
Aunque se han descrito más de 100 especies, solo unas pocas causan infecciones a los Humanos. La mayoría de los casos identificados en humanos son causados por B. microti (denominado a veces Theileria microti) y B. divergens. En animales, B. canis, B. bigemina y B. bovis causan una forma particularmente grave de la enfermedad, incluyendo una anemia severa. B. duncani (o Babesia WA-1) ha mostrado una alta virulencia en hamsters y puede causar trastornos sintomáticos en humanos.Es filogenéticamente similar a B. equi y al patógeno canino B. gibsoni.
Ciclo vital
El ciclo vital de B. microti envuelve dos huéspedes, usualmente un roedor y una garrapata. La explicación puede seguirse en la figura de abajo.
- Etapas en el roedor . Los esporozoitos se introducen en el flujo sanguíneo del roedor mediante una picadura de la garrapata . Los esporozoitos entran en los eritrocitos, convirtiéndose en trofozoitos. Comienza una etapa de reproducción asexual (gemación) que libera en la sangre merozoitos, la mayoría de los cuales infectan nuevos eritrocitos . En la sangre, algunos merozoitos se diferencian en gametos masculinos y femeninos, aunque estos no pueden diferenciarse al microscopio óptico .
- Etapas en la garrapata (ciclo A izquierda). Cuando una garrapata pica a un roedor infectado, los gametos se fusionan en el intestino de la garrapata dando lugar a un zigoto. Los zigotos, a su vez, se convierten en oocinetos móviles que entran en las glándulas salivares de la garrapata . Comienza un ciclo de esporogonia que da como resultado nuevos esporozoitos, que pueden volver a ser inyectados en un roedor por la picadura de la garrapata.
- Etapas en el humano . Los seres humanos entran en el ciclo cuando son picados por garrapatas infectadas. A través de la picadura se introducen esporozoitos en la sangre . Al igual que en el roedor, los esporozoitos entran en los eritrocitos convirtiéndose en trofozoitos y mediante gemación se forman los merozoitos. La multiplicación en la sangre es la responsable de los síntomas clínicos de la enfermedad. Los seres humanos son, a efectos prácticos, un callejón sin salida para el parásito, pues la probabilidad de que una misma persona vuelva a ser picada por otra garrapata es muy pequeña. Sin embargo, podría producirse una transmisión persona a persona a través de una transfusión de sangre .
Hallazgos clínicos
Algunos de estos signos suelen estar presentes:
- Hipertermia
- Postración
- Bilirrubinuria
- Hemoglobinuria
- Anemia
El diagnóstico diferencial más frecuente en el Gran Buenos Aires, y más si se trata de un paciente adulto, es la Leptospirosis.
Existen pacientes con Babesiosis y Proteinuria, por lo tanto estaría siempre indicado realizar un frotis en un perro sospechoso o bien que haya tenido o tenga garrapatas.También puede observarse hepatoesplenomegalia que se debe a la congestión pasiva e hiperplasia del sistema fagocítico mononuclear.
Valoración del enfermo
El paciente puede encontrarse en estado grave, que requerirá un tratamiento de sostén agresivo y urgente. El mismo deberá instaurarse antes de llegar al diagnóstico de certeza.Estos pacientes evidencian un hematocrito bajo, palidez de las mucosas con o sin ictericia. En algunos casos pueden presentarse petequias por comienzo de una CID). Los pacientes premortem suelen tener insuficiencia respiratoria (mucosas porcelana y fumando en pipa).Los enfermos moderados suelen presentar síndrome febril y alteraciones urinarias (bilirrubinuria, proteinuria y hemoglobinuria).También la babesiosis puede presentarse en forma leve con anemia ligera y decaimiento, eludiendo de este modo al clínico.
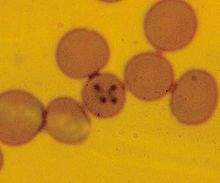
Diagnóstico de certeza El diagnóstico se efectúa al observar trofozoítos basófilos piriformes que miden 2.4 µm x 5 µm en el interior de los hematíes en los frotis sanguíneos.
Deberán realizarse extendidos de sangre capilar debido a que el acantonamiento de los eritrocitos es mayor en estos vasos. Un frotis de sangre periférica obtenida por punción de la vena cefálica antebraquial, de la safena externa, etc. con resultado negativo, no descarta esta patología. Por este motivo deberá obtenerse la muestra por punción de la cara interna del pabellón auricular, para lo cual debemos higienizar y luego desinfectar la zona de punción, teniendo cuidado que no queden restos de alcohol o antiséptico. Colocar una pequeña gota de sangre en unos de los extremos del portaobjetos y con otro, realizar un extendido fino. No colocar el porta en la heladera, con solo secarlo al aire es suficiente.
En sangre periférica acompañando la anemia regenerativa se observa anisocitosis, poiquilocitosis, policromasia y glóbulos rojos nucleados. Otros hallazgos comunes en esta enfermedad son la hiperbilirrubinemia, trombocitopenia, bilirrubinuria, hemoglobinuria.
Volviendo a Fito:
El hemograma mostró un hematocrito de 53%, GR: 7.400.000 mm3, Hemoglobina 19 mg/dl, GB: 8250 mm3, Ns: 79%, Nb: 1%, L: 10%, Eo: 1%, Ba: 0 y Mo: 9%, CUS: 23,61 , Creatinina: 1,27 , ALT: 23 y Prot. Tot: 8,9. El sedimento urinario arrojó: Espermatozoides abundantes, glóbulos rojos moderada cantidad, glóbulos blancos moderada cantidad, cilindros granulosos finos abundantes, cristales de bilirrubina escasos. El frotis de sangre capilar fue positivo a Babesia.
Tratamiento etiológico
Se realiza mediante la aplicación de Dipropionato de Imidocarb por vía intramuscular. Esta droga interfiere con el metabolismo de los ácidos nucleicos y tiene un bajo metabolismo por lo que su acción persiste por varias semanas, el margen terapéutico es escaso, su principal efecto tóxico es la necrosis hepática y ocasionalmente necrosis tubular renal.
El específico en nuestro medio es el Imizol para bovinos, con una dosis para el canino de 6 mg/Kg. La aplicación debe ser intramuscular, la administración endovenosa disminuye el margen terapéutico, por lo tanto hay que evitar esta vía. Este medicamento presenta efectos colaterales muscarínicos con salivación, vómitos, diarrea y taquicardia, etc.. Es adecuado utilizar atropina y mantener al paciente hospitalizado por 24 horas (ver tratamiento de sostén).
Se puede repetir el tratamiento a los 15 días si el paciente no se ha negativizado.
No debemos olvidar que los organofosforados poseen también efectos muscarínicos, por lo que la administración de estas drogas en forma conjunta potencia los efectos tóxicos y es por tanto desaconsejable.
Tratamiento sostén
Este tratamiento es crucial en el enfermo grave, que requerirá glucocorticoides, transfusión de sangre fresca y heparina (en caso de CID).
En anemias muy severas será conveniente utilizar concentrado globular.
En caso que el animal manifieste los efectos adversos al imidocarbo, se aconseja administrar atropina vía subcutánea.
Si se presenta diarrea severa deberá instaurarse fluidoterapia, básicamente con solución de ClNa o Ringer Lactato EV.
Tratamiento sintomático
En caso de hipertermia se podrá utilizar dipirona 15 a 20 mg/Kg para dar bienestar al enfermo.