Colágeno
Colágeno. El colágeno esta considero como el elemento estructural más importante en los seres vivos conocidos. El colágeno es la proteína más abundante en los animales superiores, pudiendo suponer un tercio de todas las proteínas del cuerpo.
Sumario
Propiedades
Sus principales propiedades son
- Gran resistencia a la tensión.
- Su relativa inextensibilidad.
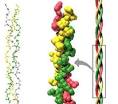
La molécula de colágeno es una estructura helicoidal compleja cuyas propiedades mecánicas se deben tanto a su composición biomecánica, como a la disposición de sus moléculas.
Composición
El colágeno esta formado por muchas moléculas de aminoácidos, pero se destacan tres principalmente.
Funciones
Su principal función es brindarle al organismo el armazón o matriz de sustentación en la que toman forma los órganos y tejidos, siendo además responsable por la firmeza, elasticidad e integridad de las estructuras e hidratación del cuerpo; por la transmisión de fuerza en los tendones y ligamentos; por la transmisión de luz en la córnea; por la distribución de fluidos en los vasos sanguíneos y conductos glandulares, etc. La elasticidad y la flexibilidad común en los jóvenes, se debe al alto contenido de colágeno que ellos poseen.
Estructura
El colágeno está compuesto por tres cadenas que forman una triple hélice. Cada cadena tiene unos 1400 aminoácidos de los cuales uno de cada tres es una glicina. A intervalos regulares se encuentran otros aminoácidos, la prolina y la hidroxiprolina, poco frecuentes en otras proteínas. La presencia de estos aminoácidos particulares permite que las tres cadenas se enrrollen una alrededor de la otra formando una fibra muy resistente. Además, entre las cadenas se establecen puentes de hidrógeno que confieren al colágeno una gran estabilidad
Formación
Cada una de las cadenas polipeptídicas es sintetizada por los ribosomas unidos a la membrana del retículo endoplásmico y luego son traslocadas al lumen del mismo en forma de grandes precursores (procadenas), presentando aminoácidos adicionales en los extremos amino y carboxilo terminales.
En el retículo endoplásmico los residuos de prolina y lisina son hidroxilados para luego algunos ser glucosilados en el aparato de Golgi, parece ser que estas hidroxilaciones son útiles para la formación de puentes de hidrógeno intercatenarios que ayudan a la estabilidad de la superhélice.
Tras su secreción, los propéptidos de las moléculas de procolágeno son degradados mediante proteasas convirtiéndolas en moléculas de tropocolágeno asociándose en el espacio extracelular formando las fibrillas de colágeno.
La formación de fibrillas está dirigida, en parte, por la tendencia de las moléculas de procolágeno a autoensamblarse mediante enlaces covalentes entre los residuos de lisina, formando un empaquetamiento escalonado y periódico de las moléculas de colágeno individuales en la fibrilla.
Disminución del colágeno
Entre los 20 a 30 años de edad su producción comienza a declinar progresivamente, cerca de los 60 años su producción total ha disminuido en más de un 35 %.
Enfermedades relacionadas al colágeno
Se conocen algunos los detalles de los defectos que pueden producirse en la síntesis del colágeno y en las enfermedades asociadas:
- Síndrome de Ehlers-Danlos: reciben este nombre un conjunto de por lo menos 10 desórdenes que son clinica, genética y bioquímicamente diferentes, pero que se manifiestan todos ellos por una debilidad estructural del tejido conjuntivo.
- Osteogénesis imperfecta: se conocen al menos 4 enfermedades con este nombre caracterizadas por fracturas múltiples y deformidades.
- Escorbuto: resulta de la deficiencia de vitamina C en la dieta, con lo cual no puede formarse la hidroxiprolina ya que la enzima lisil-oxidasa necesita esta vitamina como cofactor. El colágeno de los enfermos de escorbuto en menos estable de lo normal lo que explica muchas de las manifestaciones clínicas de esta enfermedad.
- Síndrome de Marfan: un desorden del tejido conjuntivo que afecta sobre todo a los sistemas musculoesquéletico y cardiovascular y a los ojos. Los pacientes muestran una complexión asténica, con estatura alta, largos brazos y manos y dedos como los de una araña. La musculatura está pobremente desarrollada, con poca grasa subcutánea y una gran laxitud de las articulaciones y ligamentos. La enfermedad se debe a una mutación del gen FBN1 que codifica la fibrilina-1.
- Cutis laxo: una enfermedad muy rara, adquirida o congénita, en la que la degeneración de las fibras elasticas de la piel hace que esta quede suelta y pendulante. La enfermedad se debe a un defecto de la lisil-oxidasa, una enzima dependiente de cobre que cataliza las reacciones de entrecruzamiento de la elastina
Kuivaniemi et al. (1997) han revisado los datos sobre las cerca de 278 diferentes mutaciones encontradas en los genes que codifican los colágenos tipos I, II, III, IX, X, y XI de 317 pacientes no relacionados. La mayor parte de las mutaciones (217; 78% del total) fueron de una sola base, bien por intercambio de un codón de un aminoácido crítico bien por un empalme anormal del RNA.
Las mutaciones de estos 6 colágenos ocasionan un amplio espectro de enfermedades del hueso, cartílago y vasos sanguíneos, incluyendo la osteogenesis imperfecta, una amplia variedad de condrodisplasias, síndrome de Ehlers-Danlos tipos IV y VII y, ocasionalmente, tipos raros de osteoporosis, osteoartritis y aneurisma familiar.
Uso en la medicina
El colágeno se utiliza en cirugía cosmética en la llamada terapia de sustitución de colágeno, procedimiento que consiste en inyectar subcutáneamente colágeno natural o sintético en las áreas en las que se quiere que desaparezcan arrugas, cicatrices u otras imperfecciones de la piel.
También se están utilizando como soporte en cultivos de células cartilaginosas para implantar posteriormente a pacientes que han sufrido lesiones, con una nueva tecnología denominada ingeniería de tejidos.