Ley de Avogadro
| ||||||
Ley de Avogadro. Es una de las leyes de los gases ideales. El Principio o Ley de Avogadro es el hecho experimental expresado en las leyes de Gay-Lussac, de que la relación de los volúmenes en que se combinan los gases es sencilla, y supone que debe haber una relación también sencilla entre los volúmenes de los gases y el número de moléculas contenidas en estos volúmenes.
Introducción
El científico italiano Amedeo Avogadro propuso en 1811 que volúmenes iguales de gases diferentes en iguales condiciones de presión y temperatura contienen el mismo número de moléculas. Desde Avogadro hasta nuestros días, la palabra partícula se emplea para designar tanto átomos como moléculas.
Este enunciado, de gran importancia en el campo científico, se conoce con el nombre de principio de Avogadro. Casi simultáneamente llegó a iguales conclusiones el científico francés Ampere, por lo que el principio también se conoce con el nombre de principio de Avogadro y Ampere.
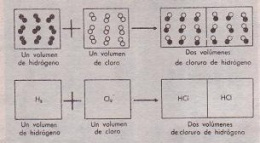
Si volúmenes iguales de gases contienen igual número de moléculas, los volúmenes de los gases que reaccionan y los que resultan estarán en relaciones sencillas.
Volumen molar
El volumen de los gases puede variar fácilmente cuando cambian la temperatura y la presión. De aquí que sea necesario especificar condiciones de temperatura y presión tijas para medir el volumen de los gases. La temperatura elegida es 0°C y la presión de 760 mm (1 atmósfera) y reciben el nombre de temperatura y presión normales (TPN), o sencillamente, condiciones normales.
Se ha demostrado experimentalmente que el mol de cualquier gas en condiciones normales ocupa siempre un volumen de 22,4 l, Este volumen de 22,4 l se conoce con el nombre de volumen molar.
Esa constancia en el volumen molar de un gas, se explica por el hecho de que los tamaños de las moléculas gaseosas sean despreciables cuando son comparados con el espacio vacío que hay entre ellas.
Así, si un globo de gas fuese llenado con 2 gramos de gas hidrógeno (masa de 1 mol de moléculas de H2 y sometido a presión externa de 1 atm y a una temperatura de 0°C, adquirirá el volumen de 22,41 litros.
El nombre de Avogadro ha quedado ligado al del número de Avogadro que indica el número de moléculas contenidas en un mol.
Fuentes
- Química Tomo I Colectivo de autores. Instituto del libro 1977, pag.109-110.