Urosepsis
| ||||||
Urosepsis. La sepsis urológica es la expresión más grave de las infecciones urológicas complicadas, ya que la forma de presentación puede ser rápida, agresiva y mortal.
Historial
El paciente urológico presenta unas peculiaridades especiales, ya que los factores que favorecen y mantienen la uropatía obstructiva favorecen la infección. Por otra parte, algunas terapéuticas establecidas ante infecciones urinarias no diagnosticadas correctamente son inadecuadas y también cronifican el proceso al favorecer la aparición de sepsis.
Existen una serie de factores predisponentes que hay que valorar seriamente ante una infección urinaria, ya que aumentan el riesgo de sepsis de origen urológico. Los más importantes son los fisiológicos como la edad o el embarazo, los metabólicos como la diabetes, las infecciones concomitantes como la tuberculosis o el síndrome de inmunodeficiencia adquirida (SIDA), la uropatía asociada con la litiasis o las hidronefrosis y las maniobras instrumentales urológicas como los cateterismos.
Algunos autores utilizan el término bacteremia, que significa presencia de bacterias en el torrente sanguíneo. Consideramos que es más significativa la palabra urosepsis, ya que implica no solo la presencia de bacterias en la sangre, sino alteraciones metabólicas y hemodinámicas que determinan un cuadro clínico grave.
Etiopatogenia
La mayoría de las infecciones urinarias son de origen ascendente, canalicular y relacionadas con exploraciones instrumentales y sondajes. El origen hematógeno es excepcional.
Los patógenos causantes de la sépsis urinaria son los habituales de las infecciones urinarias, es decir, los Gram negativos como Escherichia coli (80 %), Klebsiella, Proteus, Enterobacter y Pseudomonas. Estos gérmenes suelen anidar en la próstata, el riñón y el testículo formando un foco séptico, pero cuando entran en la circulación sanguínea pasan a ser un foco de sepsis y producen una bacteremia que según su intensidad, las características del germen y la duración del paso de gérmenes ocasiona una sepsis más o menos grave.
La mayoría de las sepsis se controlan bien con los antibióticos que disponemos en la actualidad y con la cirugía asociada más idónea para cada caso. Pero la situación más extrema de la sepsis es el shock séptico, que implica alteraciones hemodinámicas muy graves producidas por las toxinas de los gérmenes. Los fracasos respiratorios y circulatorios asociados hacen que sea necesario tratar a estos pacientes en las unidades de cuidados intensivos, ya que casi siempre van asociados a fallo multiorgánico. Al inicio del cuadro pueden aumentar las resistencias periféricas, pero posteriormente disminuyen y se eleva el gasto cardíaco. Se produce una vasoconstricción generalizada que afecta a todos los tejidos corporales, con la producción de anoxia tisular que afecta a los tejidos nobles como el miocardio, el cerebro, el hígado, el riñón, entre otros, ocasionado hipotensión, estupor, insuficiencia hepática y renal, es decir, fallo multiorgánico. Todo ello producido por las endotoxinas liberadas por los bacilos al desintegrarse en su paso a la sangre produciendo un shock endotóxico.
En el fallo multiorgánico por shock séptico comúnmente aparece coa- gulación vascular diseminada (CID) ocasionada por un gran consumo de plaquetas y factores de la coagulación, lo que ocasiona diversos cuadros hemorrágicos.
Cuadro clínico
La forma de presentación es progresiva. Al principio suele haber fiebre, le sigue el período bacterémico y, finalmente, el establecimiento del shock. La bacteremia suele presentarse con fiebre y escalofríos que se autolimitan. La mayoría de las veces aparecen después de exploraciones instrumentales como cateterismos, biopsias prostáticas, entre otras, y también después de litotricias o intervenciones quirúrgicas urológicas como la resección transuretral de próstata (RTU). Se acompañan de taquicardia y leucocitosis con desviación a la izquierda. Generalmente estas situaciones clínicas suelen resolverse de forma espontánea en poco tiempo con un antibiótico adecuado.
En el período bacterémico o de sepsis propiamente dicha, persisten la fiebre, los escalofríos y la taquicardia, pero como consecuencia de la misma aparece también postración, mialgias erráticas, debilidad, náuseas, vómitos, somnolencia y taquipnea. Como signos bioanalíticos, además de la leucocitosis con eosinopenia, aparece en una primera fase, proteinuria, hiperglicemia y alteración funcional hepática.
La fase de shock séptico se caracteriza por unas manifestaciones clínicas mucho más graves e importantes: hipotermia, distrés respiratorio, oliguria, estupor y alteraciones de la coagulación como coagulación vascular diseminada, es decir, todos aquellos signos que indican el fallo multiorgánico. En los análisis aparecen leucopenia, trombocitopenia, anemia, hipoglucemia, insuficiencia renal con aumento de azoemia y creatinina, acidosis láctica. El descenso de las resistencias vasculares periféricas, seguido de la caída de la presión arterial, es lo que marca el estado de shock.
Estas formas clínicas evolutivas de sepsis urológica se presentan en el transcurso de pocas horas o a lo largo de varios días, según la etiología de la lesión desencadenante, de las defensas y estado inmunológico del paciente, por lo que la localización del foco inicial es fundamental para iniciar cuanto antes el tratamiento.
Un punto aparte, por su gravedad, merece la sépsis urológica en los pacientes inmunodeprimidos (SIDA, diabetes, trasplante, ancianos, leucopénicos por quimioterapia, entre otros), en los que la forma de presentación es muy rápida y el shock se establece de inmediato. En estos casos la mortalidad es mucho más elevada.
Diagnóstico
La sepsis urológica ha de basarse en el diagnóstico del cuadro séptico, el germen causal y el foco infeccioso o enfermedad desencadenante. La enfermedad séptica se basa en la clínica y puede ser variable según se trate de una bacteremia o de un shock séptico, puesto que se manifiesta desde un simple cuadro de fiebre y escalofríos hasta importantes altera-ciones hemodinámicas, es en esta fase cuando hay que valorar si ha habido instrumentación urológica previa.
La confirmación de la sospecha clínica se obtiene mediante los estudios microbiológicos que permiten identificar el germen patógeno en orina y sangre. El hemocultivo debe realizarse en la fase pirética, ya que el rendimiento de cultivos positivos en este momento es casi del 90 %.
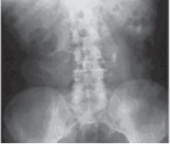
Para la localización del foco infeccioso es necesario un estudio del aparato urinario. La radiografía del TUS (figura 1)
ilustra la presencia de
litiasis y borramientos de líneas del psoas. La ecografía indicará la presencia o no de uropatía obstructiva, litiasis radiotransparente, colecciones perirrenales y siluetas renales con desestructuración o no de las mismas. La urografía intravenosa informa de la desestructuración de los cálices, con amputaciones y desplazamientos de estos y también de la silueta renal y sus posibles compresiones. La punción percutánea translumbar ecodirigida, como diagnóstico y tratamiento desobstructivo, ha sustituido hoy a la pielografía ascendente, que se utiliza solamente para situaciones concretas.
Tratamiento
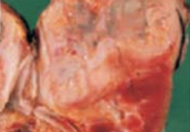
Debe basarse en la eliminación del foco séptico, la antibióticoterapia y
el soporte hemodinámico. La eliminación del foco séptico (figura 2)
vendrá dado por el diagnóstico obtenido anteriormente. El cateterismo ureteral o la punción percutánea translumbar en las uropatías obstructivas, el sondaje vesical si hay retención aguda de orina con residuos posmiccionales infectados y el debridamiento de abscesos ya sea quirúrgico abierto
(figura 3),
percutáneo o endoscópico es parte de su terapéutica.
En cuanto a la antibióticoterapia, en la mayoría de los casos hay que iniciar un tratamiento empírico que intente cubrir el máximo espectro de gérmenes, ya sea con un antimicrobiano o con la combinación de dos de ellos. Generalmente, asociamos un aminoglucósido con una cefalosporina de tercera generación. La elección del fármaco depende de que la sospecha sea de infección intra o extrahospitalaria. A la recepción del uro y el hemocultivo, con el antibiograma, decidiremos el antibiótico más conveniente.
El tratamiento del shock se realiza, la mayoría de las veces, en una unidad de cuidados intensivos, pero frecuentemente estas están llenas y tenemos que iniciar el tratamiento en las primeras horas bajo nuestra responsabilidad. A causa de la hipotensión por vasodilatación periférica y el paso de líquido al tejido intersticial, es fundamental su reposición mediante sueroterapia. Especialmente indicados aquí están los expansores del plasma, como el suero salino fisiológico y el ringer lactato. Por otra parte, para mejorar la presión sanguínea cerebral, hepática, cardíaca y renal se administra dopamina con dosis de 5-10 μg/kg/min. Por encima de 15 μg/kg/min su efecto es vasoconstrictor. Otros fármacos vasoactivos adrenérgicos que eventualmente pueden utilizarse en el shock séptico son la dobutamina, el isoproterenol y la noradrenalina, aunque, sin duda, en la actualidad la dopamina sigue siendo la más utilizada.
Pueden emplearse los corticoides, ya que aumentan el volumen cardíaco y mejoran la perfusión. La administración de dosis elevadas de corticoides reduce la mortalidad, con una baja incidencia de complicaciones. Una de las pautas más aceptada es la de 30 mg/kg de peso de metilprednisona seguida de dosis intravenosas de 100-250 mg cada 4 a 6 horas durante 48 a 72 horas.
En caso de coagulación intravascular diseminada, debe considerarse la administración de heparina. También debemos remarcar que debido al catabolismo y al déficit inmunitario de estos pacientes es necesario recurrir a la nutrición parenteral cuando se estabiliza la situación hemodinámica. Esta alimentación parenteral se administrará en forma de glucosa hipertónica, lípidos, aminoácidos, electrólitos y vitaminas.
La pielonefritis aguda es una de las urgencias médicas urológicas más frecuentes en la mujer que se define como “un proceso inflamatorio de las cavidades pielocaliciales con participación concomitante del parénquima e intersticio renal”.
Puede tener como antecedentes el padecer de infecciones urinarias a repetición, de expulsar cálculos, de intervenciones quirúrgicas urológicas, de ptosis renal, señalando al interrogatorio que desde hace unas horas presenta dolor lumbar bilateral moderado, con fiebre alta, escalofríos, ardor miccional, orinas turbias a veces con hematurias, náuseas, vómitos y al examen físico se constata el dolor lumbar a la puño percusión en las fosas lumbares afectas, los puntos pielorenoureterales (PPRU) posteriores dolorosos y taquicardia.
Con este cuadro clínico se le indican los exámenes complementarios de urgencia para llegar al diagnóstico positivo como es el TUS para descartar el factor local causante de la infección, el ultrasonido renal para definir que no presente hidronefrosis o litiasis renoureteral, hemograma con diferencial y parcial de orina observando leucocitos y hematíes abundantes.
El diagnóstico diferencial se realiza con el cólico nefrítico, descartándose el mismo ya que es “el dolor más intenso que puede tener el hombre”, con bradicardia por estímulo vagal y es unilateral. El cólico hepáticose descarta por ser el dolor en el hipocondrio derecho que se irradia a la fosa lumbar y se observa en mujeres obesas, multíparas con intolerancia a las grasas, los huevos y los chocolates. La sacrolumbalgia aguda con el antecedente de haber realizado un esfuerzo físico, aumenta el dolor en el área sacrolumbar a los movimientos, no hay fiebre. La apendicitis aguda retrocecal, cuidado con ella, ya que confunde con el cólico nefrítico derecho por tener dolor abdominal y lumbar, pero las maniobras abdominales para detectar si hay irritación peritoneal como son la Murphy, Bloomberg, Rowsing, Geneau de Musy, bien la diferencian.
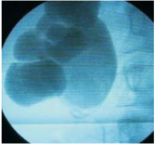
Las complicaciones de la pielonefritis aguda se inician evolucionando hacia la cronicidad a la llamada pielonefritis crónica, se puede asociar a la
litiasis produciendo una hidronefrosis (figura 4)
que a su vez se complica con un absceso perinefrítico, evolucionando a la atrofia renal, la
hipertensión arterial y la muerte del enfermo.
El tratamiento de la pielonefritis aguda está basado en los pilares siguientes: hidratación endovenosa, antibióticos, analgésicos, antieméticos. Se le puede administrar una venoclisis de 1 000 ml de dextrosa al 5 % con dos bulbos de nitrofurantoína de 180 mg (furadantin) más una ámpula de avafortan y una ámpula de gravinol a 30 got/min durante 8 horas y se le repite la venoclisis de 1 000 ml con la mitad de medicamentos antes utilizados a durar 8 horas. Al término de las dos venoclisis administradas debe mejorar el paciente y se envía para su casa con tratamiento de antibióticos por vía oral, con el consejo que asista a su médico de familia para su valoración y chequeo por consulta externa. En el caso que persista con su cuadro clínico sin mejorar, se ingresa al paciente en la sala para estudio del factor local que hace que persista la infección y aplicamos tratamiento con otros quimioterápicos como el ácido nalidíxico, el sulfaprin, el sulfixozasol, entre otros, así como antibióticoterapia de amplio espectro durante 14 días.
Fuente
- URGENCIAS UROLÓGICAS Autor: Dr. C. Armando R. Iturralde Codina (Especialista de Segundo Grado en Urología, Profesor Titular de la Facultad de Medicina, "10 de Octubre" del Instituto Superior de Ciencias Médicas de La Habana). Editorial Ciencias Médicas Calle 23 No. 177 entre N y O, Vedado, Ciudad de La Habana, Cuba.