Cicloalcano
| ||||||
Cicloalcanos o alcanos cíclicos. Son hidrocarburos saturados, formados por átomos de carbono unidos a través de enlaces simples en forma de anillo. Su fórmula genérica es CnH2n. Por fórmula son isómeros de los alquenos. También existen compuestos que contienen varios anillos, denominados compuestos policíclicos.
Sumario
Propiedades físicas
Los cicloalcanos tienen características especiales debidas a la tensión del anillo. Esta tensión es a su vez de dos tipos: Tensión de anillo torsional o de solapamiento. Tensión de ángulo de enlace o angular. El ángulo de los orbitales sp3 se desvía del órden de los 109º a ángulos inferiores. Es especialmente inestable el ciclopropano cuya reactividad es similar a la de los alquenos.
Los cicloalcanos de pequeño tamaño (ciclopropano, ciclobutano) presentan una tensión importante debida a los ángulos de enlace y a los eclipsamientos. Los cicloalcanos de mayor tamaño como ciclopentano y ciclohexano están casi libres de tensión.
Presentan mayores puntos de fusión y ebullición que los correspondientes alcanos de igual número de carbonos. La rigidez del anillo permite un mayor número de interacciones intermoleculares, que es necesario romper mediante la aportación de energía, para pasar las moléculas a fase gas.
Nomenclatura
Se nombran del mismo modo que los hidrocarburos de cadena abierta de igual número de carbonos pero anteponiendo el prefijo ciclo. Los cicloalcanos con cadenas laterales se deben nombrar de la siguiente forma:
- El nombre de la cadena o radical que las forma en primer lugar si existe una ramificación se nombra sucesivamente los radicales con indicación de su posición correspondiente.
Resultan más sencillos nombrarlos como derivados de un cicloalcano que no como derivados de un compuesto de cadena abierta. Se da nombre a los sustituyentes del anillo- grupos alquilo, halógenos y sus posiciones se señalan con números. Se asigna la posición 1 a un carbono en particular y luego se numera alrededor del anillo en el sentido de las manecillas del reloj.
Los cicloalcanos presentan isomería cis/trans. Cuando los sustituyentes se encuentran por la misma cara de la molécula, se dice que están cis; cuando se encuentran por caras opuestas, se dice que están trans
Propiedades químicas
Su reactividad (con excepción de los anillos muy pequeños: ciclopropano, ciclobutano y ciclopentano) es casi equivalente a la de los compuestos de cadena abierta.
Abundancia en la naturaleza
Los cicloalcanos aparecen de forma natural en el petróleo. Los terpenos, a que pertenecen una gran cantidad de hormonas como el estrógeno, el colesterol, la progesterona o la testosterona y otras como el alcanfor, suelen presentar un esqueleto policíclico.
Los monociclos con anillos mayores (14 - 18 átomos de carbono) están presentes en las segregaciones de las glándulas del almizcle, utilizado en perfumería.
En la industria petrolera se usan para poder extraer hidrocarburos. Según la compañía de petróleos Camilo Guerrero Occidental Company, el uso de cicloalcanos en su extracción petrolifera es debido a la densidad de este componente y su cadena cerrada los hace más manejables que algunos de cadena abierta. A su vez el cicloalcano más usado en la extracción petrolífera es el ciclopentano.
Algunos cicloalcanos
Ciclopropano
El cicloalcano más simple, formado por tres átomos de carbono, es el ciclopropano. Se genera por la Reacción de Wurtz intramolecular a partir de 1,3-dibromopropano con sodio o zinc. Se trata de una sustancia muy inestable y reactiva debido a la elevada tensión del anillo.
Todos sus enlaces se encuentran en posición eclipsada. Los ángulos de enlace se desvian desde los 109º a los 60º. El esqueleto de la molécula es un triángulo, por tanto la molécula es plana. Su reactividad es parecida a la de los alquenos. En particular, son típicas las reacciones de adición con los halógenos (p. ej. con Cl2, Br2,...) que conllevan la apertura del anillo, y por tanto, están favorecidas por la disminución de la tensión angular en el seno de la molécula.
Sus derivados se encuentran en algunas sustancias biológicamente activas. Se generan convenientemente a partir del alqueno correspondiente mediante adición de un carbono.
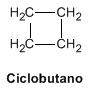
Ciclobutano
El siguiente cicloalcano más simple, formado por cuatro átomos de carbono, es el ciclobutano. Tiene enlaces en posición alternada.
Los ángulos de enlace se desvian desde los 109º a los 88º. El esqueleto de la molécula es un rombo ligeramente plegado, la molécula no es plana.
Ciclopentano
Está formado por cinco átomos de carbono. Los ángulos de enlace se desvian desde los 109,5º a los 108º. Por tanto, la tensión anular es mínima en este cicloalcano. El esqueleto de la molécula es un pentágono ligeramente plegado, ya que la molécula no es plana.
Esto es debido a que, en la conformación plana, existen 10 átomos de hidrógeno eclipsados, lo cual supone un aumento de energía de unas 10 kcal/mol.
Por lo tanto, el ciclopentano presenta su menor energía estructural en una conformación no planar, en la que uno de los vértices del pentágono está fuera del plano formado por los otros cuatro, evitando entonces tanto enclipsamiento.
Algunos autores denominan a esta estructura "conformación de sobre". Con ángulos de enlace muy próximos a los 109,5º de la hibridación sp3, la molécula del ciclopentano carece, prácticamente, de tensión anular.
Ciclohexano
Probablemente el cicloalcano más importante es el ciclohexano. Se puede obtener por hidrogenación del benceno.
El ciclohexano se dispone en forma de silla para evitar los eclipsamientos entre hidrógenos.
La forma de silla del ciclohexano contiene dos tipos de hidrógenos; los axiales que se sitúan perpendiculares al plano de la molécula y los ecuatoriales colocados en el mimo plano.
Presenta varias conformaciones que le permiten conservar el ángulo tetraédrico de 109,5 º entre los sustituyentes en los átomos de carbono. El ciclohexano no es plano sino, su diferentes conformaciones son denominadas de silla, y de bote. La forma de bote está ligeramente más elevada en energía que la forma de silla, por lo que no es tan estable.
Cicloalcanos de ciclo grande
Los cicloalcanos de tamaño mayor se generan a menudo a partir de las sales de torio de los ácidos dicarboxílicos correspondientes HOOC-(CH2)n-COOH (Síntesis de anillos largos de Ruzicka). El torio fuerza los dos extremos del ácido a unirse y luego calentando se produce bajo decarboxilación el cierre del anillo. La ciclocetona así generada puede ser reducida al correspondiente cicloalcano.
Aplicaciones
Algunos cicloalcanos como el ciclohexano forman parte de la gasolina. Además se utiliza como intermedio en la síntesis de la caprolactama y por lo tanto en la obtención de las poliamidas. El ciclohexano, la decalina (perhidronaftalina), el metilciclohexano y el ciclopentano se utilizan también como disolventes.
Toxicología
La toxicología de los cicloalcanos suele ser parecida a la de los alcanos correspondientes. El ciclohexano es menos tóxico que el hexano.
Fuentes
- B. Pavlov, A Terrrentiev .Curso de Química Orgánica traducido por Victoria Valdez Mendoza Editorial Mir Moscú 1970 pag. 471.
- K. Peter C. Vollhardt (1994). Química Orgánica. Barcelona: Ediciones Omega S.A.. ISBN 84-282-0882-4
- monografias.com
- quimicaorganica.net[1]