Metales
| ||||||
Metales. Grupo de elementos químicos que presentan todas o gran parte de las siguientes propiedades físicas: estado Sólido a Temperatura normal, excepto el Mercurio que es Líquido; opacidad, excepto en capas muy finas; buenos conductores eléctricos y térmicos; brillantes, una vez pulidos, y estructura cristalina en estado sólido.
Sumario
Formas comunes
Metales y no metales se encuentran separados en el sistema periódico por una línea diagonal de elementos. Los elementos a la izquierda de esta diagonal son los metales, y los elementos a la derecha son los no metales. Los elementos que integran esta diagonal —Boro, Silicio, Germanio, Arsénico, Antimonio, Teluro, Polonio y Astato— tienen propiedades tanto metálicas como no metálicas. Los elementos metálicos más comunes son los siguientes: Aluminio, Bario, Berilio, Bismuto, Cadmio, Calcio, Cerio, Cromo, Cobalto, Cobre, Oro, Iridio, Hierro, Plomo, Litio, Magnesio, Manganeso, Mercurio, Molibdeno, Níquel, Osmio, Paladio, Platino, Potasio, Radio, Rodio, Plata, Sodio, Tantalio, Talio, Torio, Estaño, Titanio, Volframio,Uranio, Vanadio y Zinc. Los elementos metálicos se pueden combinar unos con otros y también con otros elementos formando compuestos, disoluciones y mezclas. Una mezcla de dos o más metales o de un metal y ciertos no metales como el carbono se denomina aleación. Las aleaciones de mercurio con otros elementos metálicos son conocidas como Amalgama.
Estado natural
De conformidad con su actividad química únicamente los metales situados después del hidrógeno en la serie de actividad de los metales
| Li K Ba Ca Na Mg Al Zn Cr Fe Cd Co Ni Sn Pb H Cu Hg Ag Pt Au |
podrán encontrarse en estado libre o nativo. El cobre, el mercurio, la plata, el oro y los metales del grupo del platino son los únicos metales que se presentan en estado nativo en la Naturaleza, aunque muchos de ellos se hallan también en forma de combinación. Los minerales cuya concentración de metal es suficiente para que su extracción resulte provechosa reciben el nombre de menas. Esta concentración varia según el precio de los Metales. Así una Mena con un 10% de hierro no tiene valor metalúrgico, mientras que un mineral con un 10% de cobre justifica económicamente su explotación y un mineral con un 0,002% de oro constituye una mena valiosa de este metal. También es de importancia la composición del mineral; una mena sulfurada que tenga un 46% de hierro debe desecharse por una mena óxido con menor proporción de metal.
Historia
Los metales empezaron a utilizarse, aproximadamente, en el año 10000 a.n.e.; por eso, conocemos ese período histórico como la edad de los metales, que comenzó con la edad del cobre. 5.000 años más tarde se descubrió la fundición, lo cual supuso un gran avance. Hasta ese momento, los metales solo podían trabajarse ejerciendo fuerza sobre ellos, es decir, golpeándolos con otro metal. En cambio, la fundición permitió derretirlos, es decir, convertir el elemento sólido en líquido, al someterlo a altísimas temperaturas. De esta forma, fue posible dar a los metales la forma deseada, por ejemplo, mediante moldes. Existen diversos tipos de metales. Normalmente, se clasifican en preciosos (oro, plata, platino) y no preciosos (hierro, cobre, estaño, plomo).
Edad de los metales
Llegó un momento de la prehistoria en que los pueblos dejaron de hacer sus instrumentos con piedra y pasaron a fabricarlos con metales (porque aprendieron las técnicas necesarias para ello). La edad de los metales se divide en tres periodos.
- La Edad del Cobre. El cobre fue el primer metal utilizado por los seres humanos.
- La Edad del Bronce. Se llama así porque el hombre empezó a utilizar el bronce, después de aprender a alear (mezclar) el cobre con otro metal: el estaño. Las antiguas culturas de Mesopotamia nacieron y se desarrollaron durante la edad del bronce. Al final de ese periodo surgieron también las primeras civilizaciones de Grecia.
- La Edad de hierro. Los utensilios pasaron a fabricarse con hierro. Comenzó en Oriente Próximo hace aproximadamente 3.200 años (aunque en la mayor parte de Europa no se inició hasta hace unos 1.300 años, y en América no se trabajó el hierro hasta la llegada de los europeos a finales del Siglo XV de nuestra era). Los europeos de la edad del hierro pertenecieron, en su mayor parte, a la cultura celta. La edad del hierro acabó en casi toda Europa a medida que se producía en cada zona la conquista romana
Propiedades físicas
Las propiedades físicas de los metales más importantes son la del tipo general consideradas en cualquier sustancia, tales como la densidad, puntos de fusión y de ebullición, calor específico, conductividad calorífica, resistencia eléctrica, coeficientes de dilatación y de compresibilidad, estructura cristalina y las de tipo mecánico de gran interés técnico, que expresan la resistencia ofrecida por el metal a las distintas clases de esfuerzos a que ha sido sometido.
Los metales muestran un amplio margen en sus propiedades físicas. La mayoría de ellos son de color grisáceo, pero algunos presentan colores distintos; el bismuto es rosáceo, el cobre rojizo y el oro amarillo. En otros metales aparece más de un color, y este fenómeno se denomina pleocroísmo. El punto de fusión de los metales varía entre los -39 °C del mercurio y los 3.410 °C del volframio. El iridio, con una densidad relativa de 22,4, es el más denso de los metales. Por el contrario, el litio es el menos denso, con una densidad relativa de 0,53. La más baja conductividad eléctrica la tiene el bismuto, y la más alta a temperatura ordinaria la plata. La conductividad en los metales se puede reducir mediante aleaciones. Todos los metales se expanden con el calor y se contraen al enfriarse. Ciertas aleaciones, como las de platino e iridio, tienen un coeficiente de dilatación extremadamente bajo.
Las propiedades mecánicas más importantes son las correspondientes a efectos de tracción, compresión, flexión, torsión, cizalladura, penetración (dureza), etc. La capacidad de deformación plástica de un metal para poder ser estirado en alambres se denomina ductilidad y la plasticidad correspondiente a ser laminado o martillado en chapas delgadas recibe el nombre de maleabilidad. Los metales más maleables en el orden decreciente son oro, plata, cobre, estaño, platino, plomo, cinc y hierro. El antimonio y el bismuto son muy frágiles, pues se rompen al martillado. El hierro dulce o forjado puede doblarse y torcerse sin que se rompa, y de dice que es muy tenaz; en cambio el hierro colado o fundido se rompe a la menor flexión y por tanto es frágil.
En los metales predomina el carácter electropositivo, es decir, que tienden preferentemente a formar cationes, y en sus compuestos siempre presentan número de oxidación positivo. El enlace metálico difiere del enlace iónico y del covalente, y premite explicar muchas de las propiedades características del estado metálico.
Propiedades químicas
Las propiedades químicas características de los metales son:
- Formación de cationes: La facilidad relativa de los metales en perder electrones origina iones positivos o cationes, los cuales constituyen radicales positivos de las sales
- Sus óxidos e hidróxidos son básicos: Si un mismo metal forma varios hidróxidos, la basicidad de estos disminuye al aumentar el número de oxidación del elemento metálico.
- Los haluros son compuestos heteropolares que en disolución se disocian en los iones correspondientes: Al disolver en agua el haluro de un elemento se forman iones haluro e iones positivos del elemento unidos a moléculas de agua. Estos iones se comportan como ácidos y la cesión de protones es tanto mayor cuanto mas elevada es la carga del elemento y menor su radio.
- Actúan únicamente como reductores: La tendencia única de los metales en ceder electrones les hace comportarse como reductores. El carácter reductor aumenta con aquella tendencia y por tanto es muy elevado para los metales alcalinos y alcalinotérreos, o sea, para los elementos situados a la izquierda de la tabla periódica y mejor aun, en la parte inferior de la misma
Estructura electrónica
Los metales y aleaciones presentan enlace metálico al constituir cristales metálicos. Este tipo de enlace se encuentran en metales sólidos como el cobre, hierro y aluminio. En los metales, cada átomo metálico está unido a varios átomos vecinos. Los electrones de enlace tienen relativa libertad para moverse a través de toda la estructura tridimensional. Los enlaces metálicos dan lugar a las propiedades características de los metales. Hoy se acepta que este enlace no es precisamente entre átomos, sino un enlace entre cationes metálicos y sus electrones. El modelo más sencillo para explicarlo propone un ordenamiento de cationes en un “mar” de electrones de valencia.
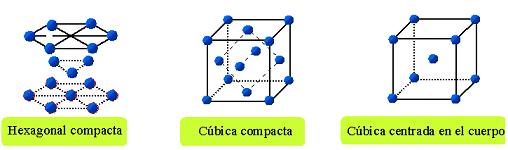
La mayoría de los metales cristalizan en el sistema cúbico, aunque algunos lo hacen en el hexagonal y en el tetragonal.
Técnicas para trabajar y decorar los metales
También existen varias técnicas para trabajar el metal. Una de ellas es el martillado, conocido también como forja: calentándolo, pero sin llegar al punto de fundición, el metal se ablanda; es entonces cuando se golpea con otro metal, obteniendo formas todavía rudimentarias. La forja se utiliza sobre todo con el hierro.
Otra técnica muy extendida es la soldadura. Consiste en la unión de varios metales por uno o varios puntos, aplicando calor en las partes que se desea unir. Esta técnica fue muy utilizada en el Siglo XX, sobre todo, por los artistas de las vanguardias europeas, como, por ejemplo, el español Julio González.
La última de las técnicas más importantes de la metalistería es la aleación. Comenzó a usarse en el 3000 a.C., 2.000 años después de la invención de la fundición. Pero, a diferencia de esta técnica, en la que se calienta un único tipo de metal, en la aleación intervienen varios tipos, creando así un metal nuevo. El ejemplo más importante de aleación es la del bronce, que es el metal que resulta de la unión del cobre y del estaño.
Decoración
Pero, al tratar los metales, hemos de explicar también cuáles son las técnicas para decorarlos.
- La primera de ellas es el repujado, quizá una de las más sencillas y primitivas que consiste en golpear el metal desde dentro hacia fuera, es decir, desde la parte no visible a la parte visible del objeto artístico o utilitario.
- Del mismo modo funciona otra de estas técnicas decorativas, la del cincelado, pero, en este caso, el metal se trabaja desde fuera hacia dentro. El resultado son incisiones o hendiduras que se realizan con punzones o gubias (similares a las que se usan en la técnica del grabado).
- Otra técnica muy importante es el dorado. El objeto de metal, en este caso, se decora con láminas de oro muy finas. Este procedimiento es similar al que usaban los pintores del románico y del gótico: los fondos de sus cuadros, e incluso las ropas de las figuras, se realizaban también con láminas de oro, que se conocen como ‘pan de oro’.
- La granulación o filigrana es otra técnica decorativa. Consiste en pegar pequeñas bolitas, normalmente de oro, que se unen entre sí formando una fina y delicada red.
- Por último, hay que hablar de la decoración con otros metales, aprovechando sus diferentes colores y texturas, y de la decoración con otros materiales, como esmaltes, marfil, jade, ámbar, etc., también muy frecuente.