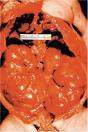
Poliquistosis renal autosómico dominante
| ||||||
Poliquistosis renal autosómico dominante. Es una enfermedad genéticamente heterogénea. Mutaciones del gen PKD1 (en el cromosoma 16p13), PKD2 (en el cromosoma 4q21-23) y PKD3 (aún no localizado) son las responsables en el 85%, 15% y menos de 1% de los casos.
Sumario
Etiología
Las correspondientes proteínas (poliquistinas) son proteínas de membrana, pero su localización subcelular y función todavía no se conocen con seguridad. La presencia de ciertas secuencias de aminoácidos sugiere que pueden participar en la interacción de células con la matriz extracelular o constituir canales para transporte de iones. La prevalencia de la poliquistosis renal de tipo autosómico dominante se estima entre 1:400 y 1:1.000. Además existe una forma de poliquistosis hepática de tipo autosómico dominante sin afección renal que también es genéticamente heterogénea.
Anatomía patológica
Los riñones suelen ser de gran tamaño y contienen numerosos quistes de dimensiones variables en la corteza y en la médula. Histológicamente el epitelio que reviste los quistes presenta áreas hiperplásicas de tipo papilar o polipoide y una alta frecuencia de apoptosis. Las membranas basales pueden ser normales o estar muy engrosadas o laminadas. Lesiones vasculares (esclerosis arteriolar) e intersticiales (inflamación y fibrosis) son frecuentes incluso en estadios poco avanzados de la enfermedad.
Patogenia
Microdisecciones de riñones poliquísticos han demostrado numerosos divertículos en todos los segmentos tubulares. El mecanismo responsable de la formación de estas dilataciones focales de los túbulos renales podría ser una alteración de la membrana basal o del tejido conjuntivo o una proliferación primaria excesiva del epitelio tubular. Sea cual fuere el mecanismo inicial, estos divertículos se desconectan, al aumentar de tamaño, de su origen tubular y crecen de forma autónoma, supuestamente por un proceso coordinado de secreción y proliferación celulares. Los quistes hepáticos se desarrollan por la dilatación progresiva de microhamartomas biliares, que están formados por pequeñas agrupaciones de conductos biliares rodeados por tejido fibroso.
El análisis de los patrones de inactivación del cromosoma X en quistes de mujeres con poliquistosis ha demostrado el origen clonal de los quistes renales y hepáticos. La pérdida de heterocigosidad con respecto a PKD1 o PKD2 en un alto porcentaje de estos quistes sugiere que la inactivación de los dos alelos de un gen PKD es el primer paso en la expansión clonal de una célula epitelial y la producción de un quiste.
Cuadro clínico
Los primeros síntomas pueden presentarse a cualquier edad, con mayor frecuencia entre la tercera y la quinta décadas de la vida. Consisten en dolor abdominal o lumbar, hematuria, hipertensión o, con menor frecuencia, infección urinaria, insuficiencia renal descubierta incidentalmente o presencia de una masa abdominal. Las causas de dolor abdominal son muy diversas e incluyen distensión producida por los quistes, hemorragia intraquística, hematuria macroscópica con coágulos, hematoma perinéfrico, nefrolitiasis o, raras veces, hipernefroma. También puede ser causado por quistes hepáticos con alguna complicación, diverticulitis y aneurismas aórticos.
La hipertensión arterial a menudo se desarrolla cuando la función renal es todavía normal. Parece probable que exista en la poliquistosis renal un defecto intrínseco renal responsable de retención de sodio, expansión de volumen e hipertensión. Los niveles de aldosterona y la actividad renina plasmática son normales o ligeramente elevados. A menudo, pero no siempre, los pacientes cuya poliquistosis renal autosómica dominante se ha detectado clínicamente y sobreviven el número de años suficiente desarrollan una insuficiencia renal. Entre el 5 y el 10% de los enfermos en programas de diálisis y trasplante renal padecen esta enfermedad. La infección de quiste renal es más frecuente en mujeres y suele estar causada por microorganismos entéricos. La palpación renal es dolorosa. Los cultivos de orina pueden ser negativos.
La poliquistosis hepática generalmente es asintomática, se desarrolla más tarde que la poliquistosis renal y tiende a ser más grave en las mujeres que en los varones. Incluso los hígados más afectos contienen suficiente parénquima residual para mantener una función hepática normal. El desarrollo de ascitis en un enfermo con poliquistosis hepática generalmente se debe a la compresión por quistes de las venas hepáticas en su confluencia con la cava inferior.
Estudios angiográficos utilizando RM detectan aneurismas intracraneales en el 5-10% de los pacientes con poliquistosis renal. La mayoría de estos aneurismas son de tamaño muy pequeño, con un diámetro inferior a 6 mm, y probablemente el riesgo de rotura es muy bajo. No obstante, la incidencia de hemorragia subaracnoidea por rotura de un aneurisma intracraneal en la poliquistosis renal es de 5 a 10 veces superior a la observada en la población general. Otros trastornos asociados a la poliquistosis renal autosómica dominante incluyen anomalías cardiovasculares (prolapso de la válvula mitral, dilatación de la raíz aórtica, aneurismas o disecciones aórticas, válvula aórtica bicúspide y coartación de aorta), divertículos de colon, hernias inguinales y anomalías esqueléticas congénitas.
Diagnóstico
El método de elección para el diagnóstico presintomático de la enfermedad, por su rapidez, sensibilidad, seguridad y costo, es la ecografía. Ésta no debe efectuarse antes de los 20 años de edad, debido al alto número de resultados falsamente negativos. El desarrollo de sondas de DNA hace posible el diagnóstico de la enfermedad a cualquier edad en familias con varios individuos afectos en las que se haya podido establecer el ligamiento genético. La detección directa de mutaciones es posible en un alto porcentaje de enfermos con PKD2. En enfermos con PKD1 es mucho más difícil debido al gran tamaño de la región codificada y a la duplicación de gran parte del gen en el cromosoma 16p.
Tratamiento
Está dirigido a la prevención de complicaciones y, si es posible, a retrasar la progresión de la insuficiencia renal. Debe prestarse especial atención a la detección precoz y al tratamiento estricto de la hipertensión, así como a la corrección de otros factores de riesgo cardiovasculares, ya que las complicaciones cardiovasculares constituyen la principal causa de mortalidad. Deben evitarse la participación en deportes de contacto y la utilización de cinturones apretados, el abuso de opiáceos o analgésicos, las manipulaciones innecesarias del tracto urinario y el uso inadecuado de diuréticos o la restricción grave de sodio en enfermos con insuficiencia renal y pérdida renal de sodio.
En enfermos con insuficiencia renal es aconsejable una restricción proteica moderada. Debido a la dificultad del diagnóstico diferencial entre pielonefritis aguda e infección de un quiste y a la posible presencia de septicemia, el tratamiento inicial es con una combinación de amplio espectro como ampicilina y un aminoglucósido. Cuando se ha aislado el microorganismo, el tratamiento debe modificarse de acuerdo con las sensibilidades in vitro. Los enfermos que no responden al tratamiento inicial probablemente tienen un quiste infectado, en cuyo caso el tratamiento debe modificarse con la inclusión de un agente liposoluble como ciprofloxacino, trimetoprima, cloranfenicol o metronidazol.
La descompresión quirúrgica o laparoscópica de riñones poliquísticos sólo está indicada en enfermos con dolor renal crónico incapacitante. Los aneurismas intracraneales con un diámetro superior a 10 mm deben tratarse quirúrgicamente; aquellos con un diámetro inferior a 6 mm tienen un bajo riesgo de rotura y deben evaluarse anualmente. No existe acuerdo general acerca del tratamiento de los aneurismas entre 6 y 9 mm de diámetro. Los enfermos con insuficiencia renal terminal son candidatos para tratamiento con diálisis y trasplante renal.
Fuente
- Ciril Ferreras Rozman, Medicina Interna, Ediciones Harcourt, 14 Edición, 2000.
- www.clinicadam.com
- Alcázar R, Egido J: Síndrome nefrótico, fisiopatología y tratamiento general. En: hernando L, ed. Nefrología Clínica. Madrid, Panamericana, 1997; 245-256.
- Brumfitt W, Hamilton-Miller J, Bailey R. Urinary Tract Infections. Londres, Chapman and Hall Medical, 1998.
- Buxbaum JN, Chuba JV, Hellman GC, Solomon A, Gallo GR. Monoclonal immunoglobulin deposition disease: light chain and light and heavy chain deposition diseases and their relation to light chain amyloidosis. Clinical features, immunopathology, and molecular analysis. Ann Intern Med 1990; 112:455-464.