Carbono-14
| ||||||
El carbono-14 es un isótopo radiactivo del carbono, de masa atómica 14.003241 uma y conocido también como radiocarbono.
El 27 de febrero de 1940, el bioquímico canadiense Martin Kamen (1913-2002) y el científico estadounidense Sam Ruben (1913-1943), que estaban realizando trabajos investigativos en el Laboratorio de Radiación de la Universidad de California en Berkeley, descubrieron este isótopo.
Se obtiene por irradiación en una pila de nitrato de calcio y está presente en muchos compuestos conocidos como acetileno, alcohol etílico, acetato de sodio, ácido esteárico, vitamina C y epinefrina entre otros.
Aplicaciones
- Materia prima de radiación para medidas de películas plásticas.
Se utiliza en la investigación de:
- Catálisis en petróleos
- Acción del Negro de Humo en el Caucho
- Función, distribución y eliminación de drogas y productos farmacéuticos en los animales.
- Efectos tóxicos de algunos productos químicos.
- Mecanismo de la fermentación.
- Reacciones térmicas y fotoquímicas de intercambio.
- Mecanismo del envejecimiento del acero.
- Estudios de flotación.
Método del carbono-14
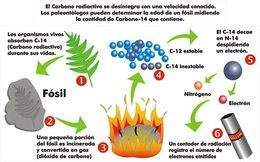
La aplicación más conocida del carbono-14 es el método de fechamiento o determinación de la edad de un vestigio orgánico (esqueleto prehistórico, madera, cenizas, restos de tejidos) basado en la cantidad de carbono radiactivo que contiene.
Basamento científico
Las radiaciones solares transmutan regularmente nitrógeno en carbono-14. El dióxido de carbono de la atmósfera contiene, por consiguiente, una proporción perfectamente determinada de dicho isótopo. También se mantiene constante dicha proporción en los organismos animales y vegetales, debido a que estos absorben directa o indirectamente el dióxido de carbono de la atmósfera.
Esta absorción cesa al morir el organismo, ya sea un árbol, una persona, cuyos restos, por mucho tiempo que pase, conservarán su carbono. Como el carbono-14 es radiactivo y se desintegra regularmente, la materia muerta irá perdiéndolo proporcionalmente al tiempo transcurrido.
Basta con medir la radiactividad presente para saber qué proporción de átomos de carbono-14 se ha desintegrado desde que murió el organismo investigado y de ahí se deduce el tiempo transcurrido.
Esto es posible porque se conoce que cada 5570 años disminuye la mitad, por desintegración, de la cantidad de átomos de carbono-14 presentes.
Este método fue desarrollado por el químico estadounidense Willard Frank Libby y su grupo.
Fuentes
- Varios autores (1965): Diccionario químico, tomo 2: «Metales y no metales y sus compuestos». La Habana: Edición Universitaria, 1965.
- Galiana Mingot, Tomás (1988): Pequeño Larousse de ciencias y técnicas. La Habana; Editorial Científico-Técnica, 1988.
- «Martin Kamen», artículo en inglés publicado en el sitio web World News.
- «1940: Martin Kamen y Sam Ruben descubren el isótopo Carbono-14», artículo del 27 de febrero de 2009 publicado en el sitio web Agencia Sinc (España).