Núcleo atómico
| ||||||
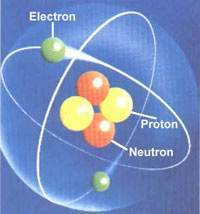
Núcleo Atómico. Es una pequeña región central del átomo donde se encuentran distribuidos los neutrones y protones, partículas fundamentales del núcleo, que reciben el nombre de nucleones. La estabilidad del núcleo no puede explicarse por su acción eléctrica. Al contrario, la repulsión existente entre los protones produciría su desintegración. El hecho de que en el núcleo existan neutrones y protones es un indicador de que debe existir otra interacción más fuerte que la electromagnética que no está directamente relacionada con cargas eléctricas y que es mucho más intensa. Esta interacción se llama interacción nuclear fuerte y es la que predomina en el núcleo.
Para explicar la naturaleza de las fuerzas nucleares que mantienen unidas a las partículas dentro de los núcleos, es necesario analizar sus propiedades. En general, un núcleo tiene masa y está cargado eléctricamente. Además, tiene un tamaño que se puede medir por su radio. Los nucleones se mueven bajo la acción de sus interacciones mutuas y la intensidad de sus interacciones se puede medir por su energía de enlace o energía de ligadura nuclear.
Sumario
Reseña histórica
El primer indicio que llevaría al establecimiento de la existencia del núcleo atómico fue el descubrimiento de la radiactividad por Antoine Henri Becquerel en 1896. Éste observó que las sales de Uranio emitían unas radiaciones que eran capaces de velar placas fotográficas en la oscuridad e incluso atravesar placas de Aluminio y Cobre. Los esposos Curie descubren otros elementos que también son emisores radiactivos, aún más activos que el Uranio, como son el Polonio y el Radio.
A mitades del siglo XX fue cuando los físicos empezaron a notar que el comportamiento de los cuerpos a escala subatómica no era el mismo que el de los planetas en un sistema solar, por ello casi simultáneamente a la Teoria de la Relatividad se estaba desarrollando la mecanica cuantica para explicar el comportamiento de los átomos y de las partículas subatómicas.
Más tarde, en 1900, Ernest Rutherford y Paul U. Villard identifican en las radiaciones emitidas tres componentes distintos: unas partículas positivas, unas negativas o electrones, ya descubiertos anteriormente por J. J. Thomson y una radiación electromagnética sin carga eléctrica, con una corta longitud de onda.
Todos estos hechos llevan a Marie Curie a escribir en 1903:
Rutherford, que con la ayuda de Frederick Soddy esboza las familias radiactivas, y tras recibir el premio Nobel de Química en 1908, es quien establece la existencia del núcleo del átomo. Ernest Rutherford propone un átomo que tenga un núcleo, donde esté concentrada la mayor parte de la masa del átomo y se encuentre la carga positiva, rodeado de electrones. Fue de nuevo Rutherford quien, en 1919, propuso que en los núcleos había protones (o lo que él llamaba partículas primeras) identificándolos con núcleos de Hidrógeno. Tras varios experimentos llevó a cabo en 1919 las primeras reacciones nucleares o transmutaciones de un núcleo en otro, utilizando partículas alfa naturales.
Heisenberg, en 1932, propone que el núcleo está formado por dos tipos de partículas: los protones y los neutrones (llamados colectivamente nucleones). Los protones tienen carga positiva e, igual y opuesta a la del electrón, y los neutrones son neutros eléctricamente. Si Z es el número atómico de un elemento, hay Z electrones en la corteza de su átomo y su núcleo tiene N neutrones, siendo A = Z + N el número de nucleones, también llamado número másico.
- Número atómico (Z): Es el número de protones que componen el núcleo del átomo. Así, el Hidrógeno (símbolo H), que es el átomo utilizado en la fusión nuclear, tiene un número Z=1, pues solamente dispone de un protón en su núcleo. De hecho, el hidrógeno es el elemento químico más sencillo —y a la vez más abundante en la naturaleza—.
- Masa atómica (A): Es la suma de protones y neutrones. También se llama número másico. Considerando N al número de neutrones de un átomo, tenemos que A = Z + N.
- Peso atómico: Es el peso del átomo, tomando como unidad la duodécima parte del peso del átomo de Carbono (C). Así, el Hidrógeno pesa aproximadamente 1 y el Carbono 12.
- Isótopo: Un mismo tipo de átomo puede tener en su núcleo distinto número de neutrones. A cada variedad se le llama isótopo. Así, como se ve en el gráfico de abajo, el hidrógeno tiene tres isótopos diferentes: isótopo hidrógeno, isótopo deuterio e isótopo tritio. Estos dos últimos son los utilizados en la fusión nuclear.
Características de los núcleos atómicos
Los núcleos atómicos tienen distintas formas geométricas, con tamaños del orden de varios fermis (10-15m). Al ser de tan pequeño tamaño, la materia está muy concentrada en los núcleos, con densidades muy altas (del orden de 1018 kg/m3). Esta densidad no depende del número másico A, los cual nos indica que su volumen es proporcional a A (pues para ser constante la densidad al crecer la masa A también ha de crecer el volumen proporcionalmente), y su radio, asimilando el núcleo a una esfera, a la raíz cúbica de A. De hecho muchos experimentos indican que el radio nuclear vale: R = R0 * A1/3
Donde R0 toma un valor aproximado de 1,2 fermis.
Por tanto, el volumen de un núcleo si se considera su forma esférica, es proporcional al número A de nucleones, y la densidad nuclear es un valor constante, 1015 veces mayor que la densidad de la materia macroscópica, lo que da una idea de la gran compacidad de los nucleones dentro de un núcleo. Así mismo, demuestra que la materia macroscópica está esencialmente vacía, ya que la mayor parte de la masa está concentrada en los núcleos.
Estabilidad nuclear
Un núcleo se considera estable si no se transmuta espontáneamente en 1021 años, si bien puede transmutarse en otros núcleos bajo ciertas condiciones. Hay 115 elementos químicos conocidos, de los cuales, 92 existen en la naturaleza y el resto han sido obtenido artificialmente. Se conocen hoy en día unos 2000 núclidos, de los cuales son estables 274. Unos 340 existen en la Naturaleza y el resto se han producido en el laboratorio. Por tanto, la mayoría de los núclidos son radiactivos.
Los núclidos radiactivos son inestables y se transforman espontáneamente con el tiempo formando otros núclidos.
Energía de enlace nuclear
Se define como la energía necesaria para separar los nucleones de un núcleo, o bien como la energía que se libera cuando se unen los nucleones para formar el núcleo.
El origen de la energía de ligadura o de enlace nuclear reside en la desaparición de una parte de la masa de los nucleones que se combinan para formar el núcleo. Esta diferencia de masa recibe el nombre de defecto másico Dm, y se transforma en energía cuyo cálculo se puede realizar por la ecuación de Einstein, E=mc2
Si a la suma de las masas de los nucleones y electrones de un átomo le restamos la masa medida experimentalmente a través del espectrógrafo de masas, obtenemos el defecto másico, y podemos calcular la energía total de enlace. La energía de enlace o de ligadura será equivalente a la energía liberada en la formación de un núcleo.
La u.m.a. se define como la doceava parte de la masa del átomo 612C y 1 u.m.a.=1'66.10-27 Kg, sustituyendo en la ecuación de Einstein, E=mc2,se obtiene E=931 MeV, es decir, 1 u.m.a. libera 931 MeV. Por tanto, la energía liberada (Ee) en la formación de un núcleo será:
Ee = Dm × 931 MeV.
La energía de enlace por nucleón se obtiene dividiendo la energía de enlace del núcleo por sus A nucleones.
Si bien en los núcleos livianos se observa un aumento abrupto de la energía de enlace por nucleón frente al número másico A, a partir de A=10, la energía de enlace por nucleón es prácticamente constante.
El máximo corresponde a núcleos semipesados con A=62 (Fe, Co, Ni), donde las fuerzas de atracción serán máximas. El decrecimiento de la energía para A>60 se debe a la repulsión eléctrica entre los protones cuyo número va aumentando y reduce por tanto la estabilidad de los núcleos. En los núcleos ligeros, cada nucleón es atraído por pocos nucleones, lo que también reduce su estabilidad.
Características de las fuerzas nucleares
- Las fuerzas nucleares son fuerzas atractivas de gran intensidad dado el tamaño de los núcleos y su enorme densidad, que predominan en el núcleo venciendo la repulsión electrostática entre los protones.
- Son de corto alcance, es decir, cada nucleón interacciona con los nucleones más próximos, si bien a distancias muy cortas, las fuerzas nucleares se hacen repulsivas lo que explica que los nucleones permanezcan a distancias medias constantes y que el volumen por nucleón sea constante.
- La fuerza de interacción entre dos nucleones es independiente de la carga, por lo que la fuerza entre dos nucleones, bien sean protón-protón, neutrón-neutrón o protón-neutrón, es aproximadamente la misma.
Fuentes
- Sánchez del Río, C. (2003). Estructura de los núcleos atómicos. En Física cuántica. Ediciones Pirámide. pp. 882-899. ISBN 978-84-368-1656-3.
- El núcleo atómico. Disponible en: http://web.educastur.princast.es/proyectos/jimena/pj_franciscga/rutherford2.htm. Consultado el 30 de mayo de 2011.
- Núcleo. Introducción histórica. Disponible en: http://www.sociedadelainformacion.com/departfqtobarra/nuclear/nucleo.htm. Consultado el 23 de julio de 2013.