Diferencia entre revisiones de «Trióxido de dinitrógeno»
m (Texto reemplazado: «<div align="justify">» por «») |
|||
| (No se muestran 9 ediciones intermedias de 4 usuarios) | |||
| Línea 1: | Línea 1: | ||
| − | {{ | + | {{Elemento_químico |
| − | |nombre=Trióxido de dinitrógeno | + | |nombre= Trióxido de dinitrógeno |
| − | | imagen= Trioxido_de_dinitrogeno.jpg | + | |imagen= Trioxido_de_dinitrogeno.jpg |
| − | | | + | |nombre,simbolo,numero= N<sub>2</sub>O<sub>3</sub> |
| − | | | + | |serie_quimica= |
| − | + | |grupo,periodo,bloque= | |
| + | |densidad= | ||
| + | |apariencia= | ||
| + | |Propiedades_atomicas= | ||
| + | |radio_medio= | ||
| + | |radio_atomico= | ||
| + | |radio_covalente= | ||
| + | |radio_de_van_der_Walls= | ||
| + | |configuracion_electronica= | ||
| + | |electrones_por_nivel_de_energia= | ||
| + | |estado_de_oxidacion= | ||
| + | |estructura_cristalina= | ||
| + | |estado_ordinario= | ||
| + | |punto_de_fusion= | ||
| + | |punto_de_ebullicion= | ||
| + | |entalpia_de_vaporizacion= | ||
| + | |entalpia_de_fusion= | ||
| + | |presion_de_vapor= | ||
| + | |velocidad_del_sonido= | ||
| + | }} | ||
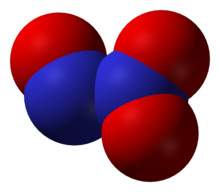
''' Trióxido de dinitrógeno ''' según nomenclatura sistemática. Su fórmula química es '''(N<sub>2</sub>O<sub>3</sub>)''', también conocido por la nomenclatura de stock como óxido de nitrógeno (III), y por la nomenclatura tradicional como sesquióxido de nitrógeno, o anhídrido nitroso, existe a bajas temperaturas como un sólido azul, posee característica de ácido débil.</div> | ''' Trióxido de dinitrógeno ''' según nomenclatura sistemática. Su fórmula química es '''(N<sub>2</sub>O<sub>3</sub>)''', también conocido por la nomenclatura de stock como óxido de nitrógeno (III), y por la nomenclatura tradicional como sesquióxido de nitrógeno, o anhídrido nitroso, existe a bajas temperaturas como un sólido azul, posee característica de ácido débil.</div> | ||
== Propiedades físicas == | == Propiedades físicas == | ||
| − | El trióxido de di[[nitrógeno]] es inestable por encima de 3°C a presión normal. Resulta sumamente poco estable al estado gaseoso, el gas se condensa en un líquido azul oscuro que hierve a 3,5°C y solidifica a –102°C a un sólido de color azul pálido. El líquido a 2°C tiene una densidad de 1,4 g/ | + | El trióxido de di[[nitrógeno]] es inestable por encima de 3°C a presión normal. Resulta sumamente poco estable al estado gaseoso, el gas se condensa en un líquido azul oscuro que hierve a 3,5°C y solidifica a –102°C a un sólido de color azul pálido. El líquido a 2°C tiene una densidad de 1,4 g/cm<sup>3</sup>. <br/>La muy baja estabilidad del trióxido de di[[nitrógeno]] (al menos en los estados [[líquidos]] y gaseosos), por lo cual puede considerarse como una mezcla equimolar de NO y NO<sub>2</sub>. Por esta razón su estructura no ha podido determinarse, aunque algunos autores proponen una estructura como la siguiente para el compuesto al estado [[sólido]]: |
| + | [[Archivo:Nitrogen_Trioxide.gif]] | ||
== Propiedades químicas == | == Propiedades químicas == | ||
| − | El trióxido de dinitrógeno al ser poco estable al estado | + | El trióxido de dinitrógeno al ser poco estable al estado gaseoso, se disocia fácilmente a monóxido y di[[óxido de nitrógeno]], en una reacción de desproporción: <br><center>N<sub>2</sub> O<sub>3</sub> (g) = NO(g) + NO<sub>2</sub> (g) </center><br>En efecto, bajo condiciones ordinarias, la [[química]] del N<sub>2</sub> O<sub>3</sub>, es la química de una mezcla equimolar de NO(g) y NO<sub>2</sub> (g)<br> El trióxido de dinitrógeno puede considerarse como el anhídrido del [[ácido nitroso]] (HNO<sub>2</sub>). Este [[ácido]] resulta también muy poco estable en disolución acuosa (y no se ha logrado aislar como tal), descomponiéndose con facilidad: <br><center>N<sub>2</sub>O<sub>3</sub>(g) + H<sub>2</sub>O = 2HNO<sub>2</sub>(ac)</center><br><center>3HNO<sub>2</sub>(ac)=2HNO<sub>3</sub>(ac) + NO(g) + H<sub>2</sub>O </center><br>No obstante esto, las sales de este hidróxido ácido se han logrado aislar (son los [[nitritos]]) y, por ejemplo, el trióxido de dinitrógeno reacciona lentamente con las álcalis con formación de los nitritos correspondientes: <br><center>N<sub>2</sub> O<sub>3</sub> (g) + 2 NaOH(s) = 2 NaNO<sub>2</sub> (ac) + H<sub>2</sub>O </center><br> Las otras propiedades químicas del trióxido de dinitrógeno, se pueden pronosticar a base del conocimiento de la química del NO(g) y NO<sub>2</sub> (g). |
| + | |||
== Obtención == | == Obtención == | ||
| − | El trióxido de dinitrógeno se produce mezclando partes iguales de [[monóxido de nitrógeno]] (NO) y | + | El trióxido de dinitrógeno se produce mezclando partes iguales de [[monóxido de nitrógeno]] (NO) y dióxido de nitrógeno (NO<sub>2</sub>), y enfriando la mezcla por debajo de –21ºC. El compuesto resultante solo es estable en las fases sólida y líquida. Al calentarse vuelve a descomponerse. |
=== Industria === | === Industria === | ||
| − | Puede obtenerse haciendo gotear [[ácido nítrico]] de densidad 1,3 g/cm3 sobre | + | Puede obtenerse haciendo gotear [[ácido nítrico]] de densidad 1,3 g/cm3 sobre óxido de arsénico(III), forma de polvo grueso: <br/><center>2 HNO<sub>3</sub>(ac) + As<sub>2</sub> O<sub>3</sub> (s) = N<sub>2</sub> O<sub>3</sub> (g) + As<sub>2</sub> O<sub>5</sub>(s) + H<sub>2</sub>O </center><br> |
| + | |||
== Contaminación ambiental == | == Contaminación ambiental == | ||
El trióxido de dinitrógeno (N<sub>2</sub> O<sub>3</sub>) y el [[tetróxido de dinitrógeno]] (N<sub>2</sub> O<sub>4</sub>) existen en concentraciones muy bajas en el gas de chimenea. Sin embargo, existen en concentraciones tan bajas en la atmósfera que tanto su presencia como su efecto son ignorados con frecuencia. | El trióxido de dinitrógeno (N<sub>2</sub> O<sub>3</sub>) y el [[tetróxido de dinitrógeno]] (N<sub>2</sub> O<sub>4</sub>) existen en concentraciones muy bajas en el gas de chimenea. Sin embargo, existen en concentraciones tan bajas en la atmósfera que tanto su presencia como su efecto son ignorados con frecuencia. | ||
| Línea 21: | Línea 43: | ||
* Babor,J. A y J. Ibarz: Química General Moderna. Tomo II. Ed. Pueblo y Educación. [[Ciudad de La Habana]], [[Cuba]]. [[1962]]. <br> | * Babor,J. A y J. Ibarz: Química General Moderna. Tomo II. Ed. Pueblo y Educación. [[Ciudad de La Habana]], [[Cuba]]. [[1962]]. <br> | ||
== Fuentes== | == Fuentes== | ||
| − | * http://www.estrucplan.com.ar | + | *[http://www.estrucplan.com.ar estrucplan] |
| − | * http://books.google.com.cu | + | *[http://books.google.com.cu books.google] |
| − | + | ||
== Enlace externo == | == Enlace externo == | ||
| − | * [http://www.ecured.cu/Nitrógeno] | + | * [http://www.ecured.cu/Nitrógeno Ecured] |
| − | + | ||
[[Category:Química]] | [[Category:Química]] | ||
última versión al 19:18 13 ago 2019
| ||||||||
Trióxido de dinitrógeno según nomenclatura sistemática. Su fórmula química es (N2O3), también conocido por la nomenclatura de stock como óxido de nitrógeno (III), y por la nomenclatura tradicional como sesquióxido de nitrógeno, o anhídrido nitroso, existe a bajas temperaturas como un sólido azul, posee característica de ácido débil.
Sumario
Propiedades físicas
El trióxido de dinitrógeno es inestable por encima de 3°C a presión normal. Resulta sumamente poco estable al estado gaseoso, el gas se condensa en un líquido azul oscuro que hierve a 3,5°C y solidifica a –102°C a un sólido de color azul pálido. El líquido a 2°C tiene una densidad de 1,4 g/cm3.
La muy baja estabilidad del trióxido de dinitrógeno (al menos en los estados líquidos y gaseosos), por lo cual puede considerarse como una mezcla equimolar de NO y NO2. Por esta razón su estructura no ha podido determinarse, aunque algunos autores proponen una estructura como la siguiente para el compuesto al estado sólido:
Propiedades químicas
El trióxido de dinitrógeno al ser poco estable al estado gaseoso, se disocia fácilmente a monóxido y dióxido de nitrógeno, en una reacción de desproporción:
En efecto, bajo condiciones ordinarias, la química del N2 O3, es la química de una mezcla equimolar de NO(g) y NO2 (g)
El trióxido de dinitrógeno puede considerarse como el anhídrido del ácido nitroso (HNO2). Este ácido resulta también muy poco estable en disolución acuosa (y no se ha logrado aislar como tal), descomponiéndose con facilidad:
No obstante esto, las sales de este hidróxido ácido se han logrado aislar (son los nitritos) y, por ejemplo, el trióxido de dinitrógeno reacciona lentamente con las álcalis con formación de los nitritos correspondientes:
Las otras propiedades químicas del trióxido de dinitrógeno, se pueden pronosticar a base del conocimiento de la química del NO(g) y NO2 (g).
Obtención
El trióxido de dinitrógeno se produce mezclando partes iguales de monóxido de nitrógeno (NO) y dióxido de nitrógeno (NO2), y enfriando la mezcla por debajo de –21ºC. El compuesto resultante solo es estable en las fases sólida y líquida. Al calentarse vuelve a descomponerse.
Industria
Puede obtenerse haciendo gotear ácido nítrico de densidad 1,3 g/cm3 sobre óxido de arsénico(III), forma de polvo grueso:
Contaminación ambiental
El trióxido de dinitrógeno (N2 O3) y el tetróxido de dinitrógeno (N2 O4) existen en concentraciones muy bajas en el gas de chimenea. Sin embargo, existen en concentraciones tan bajas en la atmósfera que tanto su presencia como su efecto son ignorados con frecuencia.
Referencias
- Blanco Prieto,J y J. Periera Simo: Química Inorgánica Parte I. Ed. Pueblo y Educación. Ciudad de La Habana, Cuba. 1986.
- Colectivo de autores: Química. Tomo I. Ed. Pueblo y Educación. Ciudad de La Habana, Cuba. 1969.
- Babor,J. A y J. Ibarz: Química General Moderna. Tomo II. Ed. Pueblo y Educación. Ciudad de La Habana, Cuba. 1962.