Diferencia entre revisiones de «Carbono-14»
(Página creada con '{{Elemento_químico |nombre=Carbono 14 |imagen= Carbono14.png |nombre,simbolo,numero=Carbono 14,C-14 |serie_quimica= |grupo,periodo,bloque= |densidad= |apariencia= |Prop...') |
|||
| (No se muestran 15 ediciones intermedias de 7 usuarios) | |||
| Línea 1: | Línea 1: | ||
{{Elemento_químico | {{Elemento_químico | ||
| − | + | |nombre=Carbono-14 | |
| − | |nombre=Carbono 14 | + | |imagen= Carbono 14.jpg |
| − | + | |nombre,simbolo,numero= | |
| − | |imagen= | ||
| − | |||
| − | |nombre,simbolo,numero= | ||
| − | |||
|serie_quimica= | |serie_quimica= | ||
| − | |||
|grupo,periodo,bloque= | |grupo,periodo,bloque= | ||
| − | |||
|densidad= | |densidad= | ||
| − | |||
|apariencia= | |apariencia= | ||
| − | |||
|Propiedades_atomicas= | |Propiedades_atomicas= | ||
| − | |||
|radio_medio= | |radio_medio= | ||
| − | |||
|radio_atomico= | |radio_atomico= | ||
| − | |||
|radio_covalente= | |radio_covalente= | ||
| + | |radio_de_van_der_Walls= | ||
| + | |configuracion_electronica= | ||
| + | |electrones_por_nivel_de_energia= | ||
| + | |estado_de_oxidacion= | ||
| + | |estructura_cristalina= | ||
| + | |estado_ordinario= | ||
| + | |punto_de_fusion= | ||
| + | |punto_de_ebullicion= | ||
| + | |entalpia_de_vaporizacion= | ||
| + | |entalpia_de_fusion= | ||
| + | |presion_de_vapor= | ||
| + | |velocidad_del_sonido= | ||
| + | }} | ||
| − | | | + | El '''carbono-14''' es uno de los tres [[isótopo]]s del [[carbono]], a saber, el carbono 12 (6 [[protón|protones]] + seis [[Neutrón|neutrones]] =C12 carbono común), el carbono 13 (6 protones + 7 neutrones = C13) y el carbono 14 (6 protones + 8 neutrones = C14). En el caso del C-14 es un isótopo [[radiactividad|radiactivo]] de [[masa atómica relativa|masa atómica]] 14.003241 [[unidad de masa atómica|uma]] y conocido también como '''radiocarbono'''. |
| − | + | == Descubrimiento == | |
| − | + | El [[27 de febrero]] de [[1940]], el [[bioquímico]] canadiense [[Martin Kamen]] (1913-2002) y el científico estadounidense [[Sam Ruben]] (1913-1943), que estaban realizando trabajos investigativos en el Laboratorio de Radiación de la [[Universidad de California]] en [[Berkeley]], descubrieron este [[isótopo]]. | |
| − | + | Se obtiene por irradiación en una pila de nitrato de [[calcio]] y está presente en muchos compuestos conocidos como [[acetileno]], [[alcohol etílico]], acetato de [[sodio]], [[ácido esteárico]], [[vitamina C]] y [[epinefrina]] entre otros. | |
| − | + | == Aplicaciones == | |
| − | + | * Materia prima de radiación para medidas de películas plásticas. | |
| − | + | Se utiliza en la investigación de: | |
| − | + | * Catálisis en [[petróleo]]s | |
| + | * Acción del Negro de Humo en el [[Caucho]] | ||
| + | * Función, distribución y eliminación de [[drogas]] y productos farmacéuticos en los animales. | ||
| + | * Efectos tóxicos de algunos productos químicos. | ||
| + | * Mecanismo de la [[fermentación]]. | ||
| + | * Reacciones térmicas y fotoquímicas de intercambio. | ||
| + | * Mecanismo del envejecimiento del [[acero]]. | ||
| + | * Estudios de flotación. | ||
| − | + | ==Método del carbono-14== | |
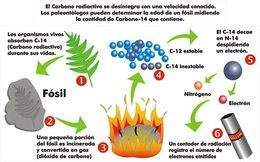
| + | La aplicación más conocida del carbono-14 es el método de fechamiento o determinación de la edad de un vestigio orgánico (esqueleto prehistórico, madera, cenizas, restos de tejidos) basado en la cantidad de carbono radiactivo que contiene. | ||
| − | | | + | ===Basamento científico=== |
| + | [[Archivo:C14-2.jpg|right|200px]] | ||
| + | Las radiaciones solares transmutan (convierten) regularmente [[nitrógeno]] en carbono-14. Esto ocurre cuando un neutrón colisiona con un átomo de nitrógeno, éste lo captura y se libera un protón. Con 6 protones, se ha convertido ya en carbono con 14 nucleones. El [[dióxido de carbono]] de la [[atmósfera]] contiene, por consiguiente, una proporción perfectamente determinada de dicho [[isótopo]]. También se mantiene constante dicha proporción en los organismos [[animal]]es y [[vegetal]]es, debido a que estos absorben directa o indirectamente el dióxido de carbono de la atmósfera. | ||
| − | + | Esta absorción cesa al morir el organismo, ya sea un [[árbol]], una [[persona]], cuyos restos, por mucho tiempo que pase, conservarán su [[carbono]]. Como el carbono-14 es radiactivo y se desintegra regularmente, la materia muerta irá perdiéndolo proporcionalmente al tiempo transcurrido. | |
| − | + | Basta con medir la radiactividad presente para saber qué proporción de [[átomo]]s de carbono-14 se ha desintegrado desde que murió el organismo investigado y de ahí se deduce el tiempo transcurrido. | |
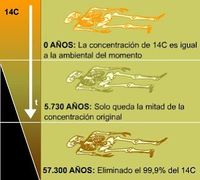
| − | + | Esto es posible porque se conoce que cada 5570 años <ref>Investigación posterior estableció que la mitad de la vida del C-14 es realmente de 5.730 años, pero la primera cifra se ha aceptado convencionalmente; la diferencia, de un 3%, es un problema menor en las muestras sin corregir. [http://laotracaradelpasado.plisweb.com/6/dataciun-por-radiocarbono]</ref> | |
| − | + | Este método fue desarrollado por el químico estadounidense [[Willard Frank Libby]] y su grupo. | |
| − | == | + | === Edad calibrada === |
| − | + | Al comparar las concentraciones teóricas de C-14 con las de muestras de maderas de edades conocidas mediante [[dendrocronología]], se descubrió que existían diferencias con los resultados esperados. Esas diferencias se deben a que la concentración de carbono radiactivo en la atmósfera también ha variado respecto al tiempo. Hoy se conoce con suficiente precisión (un margen de error de entre 1 y 10 años) la evolución de la concentración de C-14 en los últimos 15.000 años. De ese modo, puede corregirse esa estimación de edad comparándolo con curvas obtenidas mediante interpolación de datos conocidos. La edad así hallada se denomina "edad calibrada" y se expresa en años Cal BP. | |
| − | + | === La datación por Carbono-14 no sirve para datar muestras modernas=== | |
| − | + | La datación por Carbono-14 no sirve para muestras modernas porque las explosiones atómicas alteraron el equilibiro de C-14 en la atmósfera. Con cada detonación el aire se cargó con numerosos isótopos radiactivos, entre ellos el C-14. En el transcurso de algunos años, la concentración del isótopo en el hemisferio norte casi llegó a duplicarse. | |
| − | + | === La datación por Carbono-14 no sirve para datar fósiles de más de 50.000 años === | |
| − | + | La datación por Carbono-14 no sirve para datar fósiles de más de 50.000 años porque esa es la cantidad de tiempo que necesita para desaparecer completamente del organismo en cuestión. Exactamente, a los 57.300 años es de tan sólo el 0,01 % del que tenía cuando estaba vivo. Así que, si no existe C-14 en el organismo es imposible datarlo con este método y se requiere otro método. | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | + | == Referencias == | |
| − | + | <references /> | |
| − | |||
| − | + | ==Fuentes== | |
| − | [[ | + | * Varios autores (1965): ''Diccionario químico'', tomo 2: «Metales y no metales y sus compuestos». La Habana: Edición Universitaria, 1965. |
| + | * Galiana Mingot, Tomás (1988): ''Pequeño Larousse de ciencias y técnicas''. La Habana; Editorial Científico-Técnica, 1988. | ||
| + | * [https://article.wn.com/view/2002/09/09/Martin_Kamen/ «Martin Kamen»], artículo en inglés publicado en el sitio web World News. | ||
| + | * [http://www.agenciasinc.es/Multimedia/Ilustraciones/Banco-de-ilustraciones/1940-Martin-Kamen-y-Sam-Ruben-descubren-el-isotopo-Carbono-14 «1940: Martin Kamen y Sam Ruben descubren el isótopo Carbono-14»], artículo del 27 de febrero de 2009 publicado en el sitio web Agencia Sinc (España). | ||
| + | *[http://web.archive.org/web/http://www.nosams.whoi.edu/about/carbon_dating.html What is Carbon Dating?] Woods Hole Oceanographic Institute (en inglés) | ||
| + | * [https://www.ciencia-explicada.com/2012/02/por-que-la-datacion-por-carbono-14-no.html ¿Por qué la datación por Carbono-14 no sirve para muestras modernas?] | ||
| + | * [http://homepage.mac.com/uriarte/carbono14.html Carbono14] | ||
| + | * [http://abob.libs.uga.edu/bobk/nuclear.html Articulo original de Richard Firestone y Willian Topping] | ||
| + | [[Categoría: Isótopos]] | ||
| + | [[Categoría: Carbono]] | ||
última versión al 22:13 8 feb 2020
| ||||||
El carbono-14 es uno de los tres isótopos del carbono, a saber, el carbono 12 (6 protones + seis neutrones =C12 carbono común), el carbono 13 (6 protones + 7 neutrones = C13) y el carbono 14 (6 protones + 8 neutrones = C14). En el caso del C-14 es un isótopo radiactivo de masa atómica 14.003241 uma y conocido también como radiocarbono.
Sumario
Descubrimiento
El 27 de febrero de 1940, el bioquímico canadiense Martin Kamen (1913-2002) y el científico estadounidense Sam Ruben (1913-1943), que estaban realizando trabajos investigativos en el Laboratorio de Radiación de la Universidad de California en Berkeley, descubrieron este isótopo.
Se obtiene por irradiación en una pila de nitrato de calcio y está presente en muchos compuestos conocidos como acetileno, alcohol etílico, acetato de sodio, ácido esteárico, vitamina C y epinefrina entre otros.
Aplicaciones
- Materia prima de radiación para medidas de películas plásticas.
Se utiliza en la investigación de:
- Catálisis en petróleos
- Acción del Negro de Humo en el Caucho
- Función, distribución y eliminación de drogas y productos farmacéuticos en los animales.
- Efectos tóxicos de algunos productos químicos.
- Mecanismo de la fermentación.
- Reacciones térmicas y fotoquímicas de intercambio.
- Mecanismo del envejecimiento del acero.
- Estudios de flotación.
Método del carbono-14
La aplicación más conocida del carbono-14 es el método de fechamiento o determinación de la edad de un vestigio orgánico (esqueleto prehistórico, madera, cenizas, restos de tejidos) basado en la cantidad de carbono radiactivo que contiene.
Basamento científico
Las radiaciones solares transmutan (convierten) regularmente nitrógeno en carbono-14. Esto ocurre cuando un neutrón colisiona con un átomo de nitrógeno, éste lo captura y se libera un protón. Con 6 protones, se ha convertido ya en carbono con 14 nucleones. El dióxido de carbono de la atmósfera contiene, por consiguiente, una proporción perfectamente determinada de dicho isótopo. También se mantiene constante dicha proporción en los organismos animales y vegetales, debido a que estos absorben directa o indirectamente el dióxido de carbono de la atmósfera.
Esta absorción cesa al morir el organismo, ya sea un árbol, una persona, cuyos restos, por mucho tiempo que pase, conservarán su carbono. Como el carbono-14 es radiactivo y se desintegra regularmente, la materia muerta irá perdiéndolo proporcionalmente al tiempo transcurrido.
Basta con medir la radiactividad presente para saber qué proporción de átomos de carbono-14 se ha desintegrado desde que murió el organismo investigado y de ahí se deduce el tiempo transcurrido.
Esto es posible porque se conoce que cada 5570 años [1]
Este método fue desarrollado por el químico estadounidense Willard Frank Libby y su grupo.
Edad calibrada
Al comparar las concentraciones teóricas de C-14 con las de muestras de maderas de edades conocidas mediante dendrocronología, se descubrió que existían diferencias con los resultados esperados. Esas diferencias se deben a que la concentración de carbono radiactivo en la atmósfera también ha variado respecto al tiempo. Hoy se conoce con suficiente precisión (un margen de error de entre 1 y 10 años) la evolución de la concentración de C-14 en los últimos 15.000 años. De ese modo, puede corregirse esa estimación de edad comparándolo con curvas obtenidas mediante interpolación de datos conocidos. La edad así hallada se denomina "edad calibrada" y se expresa en años Cal BP.
La datación por Carbono-14 no sirve para datar muestras modernas
La datación por Carbono-14 no sirve para muestras modernas porque las explosiones atómicas alteraron el equilibiro de C-14 en la atmósfera. Con cada detonación el aire se cargó con numerosos isótopos radiactivos, entre ellos el C-14. En el transcurso de algunos años, la concentración del isótopo en el hemisferio norte casi llegó a duplicarse.
La datación por Carbono-14 no sirve para datar fósiles de más de 50.000 años
La datación por Carbono-14 no sirve para datar fósiles de más de 50.000 años porque esa es la cantidad de tiempo que necesita para desaparecer completamente del organismo en cuestión. Exactamente, a los 57.300 años es de tan sólo el 0,01 % del que tenía cuando estaba vivo. Así que, si no existe C-14 en el organismo es imposible datarlo con este método y se requiere otro método.
Referencias
Fuentes
- Varios autores (1965): Diccionario químico, tomo 2: «Metales y no metales y sus compuestos». La Habana: Edición Universitaria, 1965.
- Galiana Mingot, Tomás (1988): Pequeño Larousse de ciencias y técnicas. La Habana; Editorial Científico-Técnica, 1988.
- «Martin Kamen», artículo en inglés publicado en el sitio web World News.
- «1940: Martin Kamen y Sam Ruben descubren el isótopo Carbono-14», artículo del 27 de febrero de 2009 publicado en el sitio web Agencia Sinc (España).
- What is Carbon Dating? Woods Hole Oceanographic Institute (en inglés)
- ¿Por qué la datación por Carbono-14 no sirve para muestras modernas?
- Carbono14
- Articulo original de Richard Firestone y Willian Topping