Diferencia entre revisiones de «Terapia génica»
m (Javiermartin jc trasladó la página Terapia Génica a Terapia génica sobre una redirección) |
|||
| (No se muestran 23 ediciones intermedias de 9 usuarios) | |||
| Línea 1: | Línea 1: | ||
| − | {{Definición|Nombre=|imagen=|concepto=}} | + | {{Sistema:Artículo certificado |
| + | |contenido=el '''[[Instituto de Información Científica y Tecnológica]]''' (IDICT) | ||
| + | }} | ||
| + | {{Definición | ||
| + | |Nombre=Terapia génica | ||
| + | |imagen=Terapia_genica.jpg | ||
| + | |concepto=Consiste en la inserción de genes funcionales ausentes en el genoma de un individuo | ||
| + | }} | ||
| + | '''Terapia génica'''. Técnica terapéutica mediante la cual se inserta un gen funcional en las células de un paciente para corregir un defecto genético o para dotar las células de una nueva función. | ||
| − | == Concepto | + | == Concepto == |
| − | + | La terapia génica humana (TG) es la administración deliberada de material genético a un paciente humano con la intención de corregir un defecto genético específico, es decir, la inserción de material genético en [[célula]]s de un organismo reemplazando alelos mutados por genes con la fusión deseada, con el fin de tratar o prevenir el desarrollo de una [[enfermedad]]. | |
| − | == Requerimientos Básicos para la (TG) | + | == Requerimientos Básicos para la (TG) == |
| − | El | + | #El gen debe de estar aislado y disponible para la transferencia. |
| + | #Debe de haber un método efectivo para la clonación. | ||
| + | #El tejido diana debe de ser accesible para la transferencia del gen. | ||
| + | #No debe de existir otra terapia efectiva disponible. | ||
| + | #La terapia no debe dañar al paciente. | ||
| − | == | + | ==Tipos de terapia genética== |
| − | + | ''Terapia génica somática:'' se realiza sobre las células somáticas de un individuo, por lo que las modificaciones que implique la terapia sólo tienen lugar en dicho paciente. | |
| − | + | *Terapia in vivo: la transformación celular tiene lugar dentro del paciente al que se le administra la terapia. Consiste en administrarle al paciente un [[gen]] a través de un vehículo (por ejemplo un virus), el cual debe localizar las células a infectar. El problema que presenta esta técnica es que es muy difícil conseguir que un vector localice a un único tipo de células diana. | |
| − | + | *Terapia ex vivo: la transformación celular se lleva a cabo a partir de una biopsia del tejido del paciente y luego se le trasplantan las células ya transformadas. Como ocurre fuera del cuerpo del paciente, este tipo de terapia es mucho más fácil de llevar a cabo y permite un control mayor de las células infectadas. Esta técnica está casi completamente reducida a células hematopoyéticas pues son células cultivables, constituyendo así un material trasplantable. | |
| − | + | '''Terapia génica germinal:''' se realizaría sobre las células germinales del paciente, por lo que los cambios generados por los genes terapéuticos serían hereditarios. Por cuestiones éticas y jurídicas, ésta clase de terapia génica no se lleva a cabo hoy en día. | |
| − | == | + | == Procedimiento == |
| − | + | Aunque se han utilizado enfoques muy distintos, en la mayoría de los estudios de terapia génica, una copia del gen funcional se inserta en el genoma para compensar el defectivo. Si esta copia simplemente se introduce en el huésped, se trata de terapia génica de adición. Si tratamos, por medio de la recombinación homóloga, de eliminar la copia defectiva y cambiarla por la funcional, se trata de terapia de sustitución. | |
| − | + | Actualmente, el tipo más común de vectores utilizados son los virus, que pueden ser genéticamente alterados para dejar de ser patógenos y portar genes de otros organismos. Las células diana del paciente se infectan con el vector (en el caso de que se trate de un virus) o se transforman con el [[ADN]] a introducir. Este ADN, una vez dentro de la célula huésped, se transcribe y traduce a una proteína funcional, que va a realizar su función, y, en teoría, a corregir el defecto que causaba la enfermedad. | |
| − | + | == Vectores en terapia génica == | |
| − | == | + | === Virus === |
| − | + | Todos los virus son capaces de introducir su material genético en la célula huésped como parte de su ciclo de replicación. Gracias a ello, pueden producir más copias de sí mismos, e infectar a otras células. Algo común a la mayoría de estrategias con virus es la necesidad de usar líneas celulares "empaquetadoras" o virus helpers, que porten los genes que les eliminamos a nuestros vectores y que permiten la infección<ref>Durai S, Mani M, Kandavelou K, Wu J, Porteus MH, Chandrasegaran S (2005). "Zinc finger nucleases: custom-designed molecular scissors for genome engineering of plant and mammalian cells". Nucleic Acids Res. 33 (18): 5978–90. doi:10.1093/nar/gki912. PMID 16251401</ref>, <ref>Harwood, Adrian J. Protocols for Gene Analysis. 1st. 31. Totowa, New Jersey: Humana Press, 1994.</ref>. | |
| − | + | Algunos tipos de virus insertan sus genes físicamente en el genoma del huésped, otros pasan por varios orgánulos celulares en su ciclo de infección y otros se replican directamente en el citoplasma, por lo que en función de la terapia a realizar nos puede interesar uno u otro. Algunos ejemplos son los retrovirus, adenovirus, los virus adenoasociados, los herpes virus y los vectores virales. | |
| − | + | *Retrovirus: El genoma de los retrovirus está constituido por ARN de cadena sencilla, en el cual se distinguen tres zonas claramente definidas: una intermedia con genes estructurales, y dos flanqueantes con genes y estructuras reguladoras. Cuando un retrovirus infecta a una célula huésped, introduce su [[ARN]] junto con algunas enzimas que se encuentran en la matriz, concretamente una proteasa, una transcriptasa inversa y una integrasa. La acción de la retrotranscriptasa permite la síntesis del ADN genómico del virus a partir del ARN. A continuación, la integrasa introduce este ADN en el genoma del huésped. A partir de este punto, el virus puede permanecer latente o puede activar la replicación masivamente. Para usar los retrovirus como vectores víricos para terapia génica inicialmente se eliminaron los genes responsables de su replicación y se reemplazaron estas regiones por el gen a introducir seguido de un gen marcador. | |
| + | |||
| + | *Adenovirus: Los adenovirus presentan un genoma de ADN bicatenario, y no integran su genoma cuando infectan a la célula huésped, sino que la molécula de ADN permanece libre en el núcleo celular y se transcribe de forma independiente. Esto supone que el efecto posicional o la mutagénesis por inserción no se dan en estos vectores, lo cual no quiere decir que no tengan otros inconvenientes. Además, debido al hecho de que en su ciclo natural se introducen en el núcleo de la célula, pueden infectar tanto células en división como células quiescentes. | ||
| + | |||
| + | *Virus Adenoasociados (AAV): Los AAV son virus pequeños con un genoma de ADN monocatenario. Pueden integrarse específicamente en el cromosoma 19 con una alta probabilidad. Sin embargo, el AAV recombinante que se usa como vector y que no contiene ningún gen viral, solo el gen terapéutico, no se integra en el genoma. En su lugar, el genoma vírico recombinante fusiona sus extremos a través del ITR (repeticiones terminales invertidas), apareciendo recombinación de la forma circular y episomal que se predice que pueden ser la causa de la expresión génica a largo plazo. | ||
| + | |||
| + | Las desventajas de los sistemas basados en AAV radican principalmente en la limitación del tamaño de DNA recombinante que podemos usar, que es muy poco, dado el tamaño del virus. También el proceso de producción e infección resultan bastantes complejos. No obstante, como se trata de un virus no patógeno en la mayoría de los pacientes tratados no aparecen respuestas inmunes para eliminar el virus ni las células con las que han sido tratados. | ||
| + | |||
| + | *Herpes virus: Los herpes virus son virus de ADN capaces de establecer latencia en sus células huésped. Tienen la ventaja de poder incorporar fragmentos de DNA exógeno de gran tamaño (hasta unas 30 kb). Además, aunque su ciclo lítico lo realizan en el lugar de infección, establecen la latencia en neuronas, las cuales están implicadas en numerosas enfermedades del sistema nervioso, y son por ello dianas de gran interés. | ||
| + | |||
| + | *Vectores virales: Los vectores virales tienen poblaciones naturales de células huésped que ellos infectan de manera eficiente. Sin embargo, algunos tipos celulares no son sensibles a la infección por estos virus. La entrada del virus a la célula está mediada por proteínas de su superficie externa (que pueden formar parte de una cápside o de una membrana). Estas proteínas interaccionan con receptores celulares que pueden inducir cambios estructurales en el virus y contribuir a su entrada en la célula por [[endocitosi]]s. | ||
| + | |||
| + | ===Métodos no virales=== | ||
| + | |||
| + | *DNA Desnudo: Este método consiste en la inyección de plásmidos de DNA desnudos (o sea, no recubiertos) los cuales contienen la información genética deseada y son capases de entrar a las células y restablecer la función deseada. Este es el método de transfección no viral más simple que existe, y aunque ha mostrado algunos resultados positivos la expresión aun continua siendo muy baja en comparación con otros métodos, lo que ha llevado a una investigación con métodos más eficientes de transformación, tales como la electroporación, la sonicación, o el uso de la biobalística, que consiste en disparar partículas de oro recubiertas de ADN hacia la célula utilizando altas presiones de gas. | ||
| + | |||
| + | *Oligonucleótidos: El uso de oligonucleótidos sintéticos en la terapia génica tiene como objetivo la inactivación de los genes implicados en el proceso de la enfermedad. | ||
| + | |||
| + | ===Cromosomas artificiales=== | ||
| + | |||
| + | La creación de cromosomas humanos artificiales (HACs) estables es una de las posibilidades que se trabaja en la actualidad como una de las formas de introducir ADN permanentemente en células somáticas para el tratamiento de enfermedades mediante el uso de la terapia génica. Presentan una elevada estabilidad, además de permitir introducir grandes cantidades de información genética. | ||
| + | |||
| + | *Lipoplexes: El vector de ADN puede ser cubierto por lípidos formando una estructura organizada, como una micela o un liposoma. Cuando la estructura organizada forma un complejo con el ADN entonces se denomina lipoplexe. Hay tres tipos de lípidos: aniónicos, neutros o catiónicos, al ser los aniónicos y los neutros tóxicos los catiónicos son los más utilizados. Éstos, debido a su carga positiva, interaccionan con el ADN, que presenta carga negativa, de tal forma que facilita la encapsulación del ADN en liposomas. El uso de lípidos catiónicos mejoraba la estabilidad de los lipoplexes, además, como resultado de su carga, interactúan también con la membrana celular, permitiendo la endocitosis como la principal vía por la que las células absorben los lipoplexes. Una vez dentro de la célula el endosoma debe de romperse y liberar la carga de ADN si esto no ocurre, es eliminado. Los lipoplexes tiene como desventaja una baja eficiencia en esta etapa por lo que requieren de la ayuda de otros lípidos como desestabilizadores de la membrana del endosoma. | ||
| + | |||
| + | ===Métodos híbridos=== | ||
| + | |||
| + | Debido a las deficiencias de muchos de los sistemas de transferencia génica se han desarrollado algunos métodos híbridos que combinan dos o más técnicas. Los virosomas son un ejemplo, y combinan liposomas con el virus inactivado [[VIH]] o el virus de la gripe. | ||
| + | |||
| + | *Dendrímeros: Un dendrímero es una macromolécula muy ramificada con forma esférica o variable. Su tamaño está en la escala nanométrica y su superficie puede ser funcional de muchas formas y de ésta derivan muchas de sus propiedades. En particular, es posible construir un dendrímero catiónico, es decir, con carga superficial positiva. De esta forma, interacciona con el ácido nucleico, cargado negativamente, y formar un complejo que puede entrar por endocitosis en la célula. | ||
| + | |||
| + | ==Células diana== | ||
| + | |||
| + | Las células diana se seleccionan en función del tipo de tejido en el que deba expresarse el gen introducido, y deben ser además células con una vida media larga. Igualmente, se debe tener en cuenta si la diana celular es una célula en división o quiescente. Las células diana ideales serían las células madre, puesto que la inserción de un gen en ellas produciría un efecto a largo plazo. Debido a la experiencia en trasplante de médula ósea, una de las dianas celulares más trabajadas son las células madre hematopoyéticas. Otras dianas celulares con las que se ha trabajado son: Linfocitos, células del epitelio respiratorio, Hepatocitos, Fibroblastos dérmicos y células musculares. | ||
| + | |||
| + | ==Aplicación de la terapia génica en humanos== | ||
| + | |||
| + | La aplicación más controversial y polémica de la tecnología de los transgenes es la que respecta a la terapia génica humana, es decir, el tratamiento y alivio de las enfermedades genéticas humanas mediante la adición de genes silvestres exógenos para corregir la función defectuosa de las mutaciones. En los seres humanos puede utilizarse dos tipos básicos de terapia génica: la somática y la germinal. | ||
| + | |||
| + | La terapia génica somática es hasta ahora la que posee disímiles aplicaciones en ya no pocas enfermedades tales como: Fibrosis quística, Enfermedades lisosomales, hipercolesterolemia, melanomas malignos (cáncer), Inmuno Deficiencia Combinada Grave, Distrofia Muscular Duchene, Beta Talasemia, VIH/SIDA, entre otros. | ||
| + | |||
| + | == Referencias== | ||
| + | |||
| + | {{listaref|2}} | ||
| + | |||
| + | ==Fuentes== | ||
| + | |||
| + | *Curso de Introducción a la Biotecnología.Universidad para todos. ''Revista Biotecnología Aplicada'' | ||
| + | *Durai S, Mani M, Kandavelou K, Wu J, Porteus MH, Chandrasegaran S (2005). "Zinc finger nucleases: custom-designed molecular scissors for genome engineering of plant and mammalian cells". Nucleic Acids Res. 33 (18): 5978–90. doi:10.1093/nar/gki912. PMID 16251401 | ||
| + | *Harwood, Adrian J. Protocols for Gene Analysis. 1st. 31. Totowa, New Jersey: Humana Press, 1994. | ||
| + | *Terapia génica. Disponible en:[http://www.monografias.com/trabajos30/terapia-genica/terapia-genica2.shtml Monografías] | ||
| + | *Biotecnología. Disponible en:[http://www.ugr.es/~eianez/Biotecnologia/tgdaniel.htm Universidad de Granada] | ||
| + | *Terapia Génica. Disponible en:[http://www.news-medical.net/health/Gene-Therapy-Vectors-%28Spanish%29.aspx The Medical News] | ||
| + | |||
| + | [[Categoría:Biología molecular]] | ||
| + | [[Categoría:Bioética]] | ||
| + | [[Categoría:Biotecnología]] | ||
| + | [[Categoría:Genética]] | ||
| + | [[Categoría:Artículos certificados]] | ||
última versión al 09:18 26 mar 2025
| ||||||
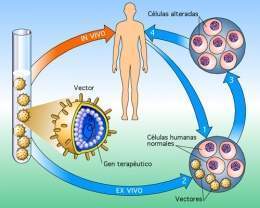
Terapia génica. Técnica terapéutica mediante la cual se inserta un gen funcional en las células de un paciente para corregir un defecto genético o para dotar las células de una nueva función.
Sumario
Concepto
La terapia génica humana (TG) es la administración deliberada de material genético a un paciente humano con la intención de corregir un defecto genético específico, es decir, la inserción de material genético en células de un organismo reemplazando alelos mutados por genes con la fusión deseada, con el fin de tratar o prevenir el desarrollo de una enfermedad.
Requerimientos Básicos para la (TG)
- El gen debe de estar aislado y disponible para la transferencia.
- Debe de haber un método efectivo para la clonación.
- El tejido diana debe de ser accesible para la transferencia del gen.
- No debe de existir otra terapia efectiva disponible.
- La terapia no debe dañar al paciente.
Tipos de terapia genética
Terapia génica somática: se realiza sobre las células somáticas de un individuo, por lo que las modificaciones que implique la terapia sólo tienen lugar en dicho paciente.
- Terapia in vivo: la transformación celular tiene lugar dentro del paciente al que se le administra la terapia. Consiste en administrarle al paciente un gen a través de un vehículo (por ejemplo un virus), el cual debe localizar las células a infectar. El problema que presenta esta técnica es que es muy difícil conseguir que un vector localice a un único tipo de células diana.
- Terapia ex vivo: la transformación celular se lleva a cabo a partir de una biopsia del tejido del paciente y luego se le trasplantan las células ya transformadas. Como ocurre fuera del cuerpo del paciente, este tipo de terapia es mucho más fácil de llevar a cabo y permite un control mayor de las células infectadas. Esta técnica está casi completamente reducida a células hematopoyéticas pues son células cultivables, constituyendo así un material trasplantable.
Terapia génica germinal: se realizaría sobre las células germinales del paciente, por lo que los cambios generados por los genes terapéuticos serían hereditarios. Por cuestiones éticas y jurídicas, ésta clase de terapia génica no se lleva a cabo hoy en día.
Procedimiento
Aunque se han utilizado enfoques muy distintos, en la mayoría de los estudios de terapia génica, una copia del gen funcional se inserta en el genoma para compensar el defectivo. Si esta copia simplemente se introduce en el huésped, se trata de terapia génica de adición. Si tratamos, por medio de la recombinación homóloga, de eliminar la copia defectiva y cambiarla por la funcional, se trata de terapia de sustitución.
Actualmente, el tipo más común de vectores utilizados son los virus, que pueden ser genéticamente alterados para dejar de ser patógenos y portar genes de otros organismos. Las células diana del paciente se infectan con el vector (en el caso de que se trate de un virus) o se transforman con el ADN a introducir. Este ADN, una vez dentro de la célula huésped, se transcribe y traduce a una proteína funcional, que va a realizar su función, y, en teoría, a corregir el defecto que causaba la enfermedad.
Vectores en terapia génica
Virus
Todos los virus son capaces de introducir su material genético en la célula huésped como parte de su ciclo de replicación. Gracias a ello, pueden producir más copias de sí mismos, e infectar a otras células. Algo común a la mayoría de estrategias con virus es la necesidad de usar líneas celulares "empaquetadoras" o virus helpers, que porten los genes que les eliminamos a nuestros vectores y que permiten la infección[1], [2].
Algunos tipos de virus insertan sus genes físicamente en el genoma del huésped, otros pasan por varios orgánulos celulares en su ciclo de infección y otros se replican directamente en el citoplasma, por lo que en función de la terapia a realizar nos puede interesar uno u otro. Algunos ejemplos son los retrovirus, adenovirus, los virus adenoasociados, los herpes virus y los vectores virales.
- Retrovirus: El genoma de los retrovirus está constituido por ARN de cadena sencilla, en el cual se distinguen tres zonas claramente definidas: una intermedia con genes estructurales, y dos flanqueantes con genes y estructuras reguladoras. Cuando un retrovirus infecta a una célula huésped, introduce su ARN junto con algunas enzimas que se encuentran en la matriz, concretamente una proteasa, una transcriptasa inversa y una integrasa. La acción de la retrotranscriptasa permite la síntesis del ADN genómico del virus a partir del ARN. A continuación, la integrasa introduce este ADN en el genoma del huésped. A partir de este punto, el virus puede permanecer latente o puede activar la replicación masivamente. Para usar los retrovirus como vectores víricos para terapia génica inicialmente se eliminaron los genes responsables de su replicación y se reemplazaron estas regiones por el gen a introducir seguido de un gen marcador.
- Adenovirus: Los adenovirus presentan un genoma de ADN bicatenario, y no integran su genoma cuando infectan a la célula huésped, sino que la molécula de ADN permanece libre en el núcleo celular y se transcribe de forma independiente. Esto supone que el efecto posicional o la mutagénesis por inserción no se dan en estos vectores, lo cual no quiere decir que no tengan otros inconvenientes. Además, debido al hecho de que en su ciclo natural se introducen en el núcleo de la célula, pueden infectar tanto células en división como células quiescentes.
- Virus Adenoasociados (AAV): Los AAV son virus pequeños con un genoma de ADN monocatenario. Pueden integrarse específicamente en el cromosoma 19 con una alta probabilidad. Sin embargo, el AAV recombinante que se usa como vector y que no contiene ningún gen viral, solo el gen terapéutico, no se integra en el genoma. En su lugar, el genoma vírico recombinante fusiona sus extremos a través del ITR (repeticiones terminales invertidas), apareciendo recombinación de la forma circular y episomal que se predice que pueden ser la causa de la expresión génica a largo plazo.
Las desventajas de los sistemas basados en AAV radican principalmente en la limitación del tamaño de DNA recombinante que podemos usar, que es muy poco, dado el tamaño del virus. También el proceso de producción e infección resultan bastantes complejos. No obstante, como se trata de un virus no patógeno en la mayoría de los pacientes tratados no aparecen respuestas inmunes para eliminar el virus ni las células con las que han sido tratados.
- Herpes virus: Los herpes virus son virus de ADN capaces de establecer latencia en sus células huésped. Tienen la ventaja de poder incorporar fragmentos de DNA exógeno de gran tamaño (hasta unas 30 kb). Además, aunque su ciclo lítico lo realizan en el lugar de infección, establecen la latencia en neuronas, las cuales están implicadas en numerosas enfermedades del sistema nervioso, y son por ello dianas de gran interés.
- Vectores virales: Los vectores virales tienen poblaciones naturales de células huésped que ellos infectan de manera eficiente. Sin embargo, algunos tipos celulares no son sensibles a la infección por estos virus. La entrada del virus a la célula está mediada por proteínas de su superficie externa (que pueden formar parte de una cápside o de una membrana). Estas proteínas interaccionan con receptores celulares que pueden inducir cambios estructurales en el virus y contribuir a su entrada en la célula por endocitosis.
Métodos no virales
- DNA Desnudo: Este método consiste en la inyección de plásmidos de DNA desnudos (o sea, no recubiertos) los cuales contienen la información genética deseada y son capases de entrar a las células y restablecer la función deseada. Este es el método de transfección no viral más simple que existe, y aunque ha mostrado algunos resultados positivos la expresión aun continua siendo muy baja en comparación con otros métodos, lo que ha llevado a una investigación con métodos más eficientes de transformación, tales como la electroporación, la sonicación, o el uso de la biobalística, que consiste en disparar partículas de oro recubiertas de ADN hacia la célula utilizando altas presiones de gas.
- Oligonucleótidos: El uso de oligonucleótidos sintéticos en la terapia génica tiene como objetivo la inactivación de los genes implicados en el proceso de la enfermedad.
Cromosomas artificiales
La creación de cromosomas humanos artificiales (HACs) estables es una de las posibilidades que se trabaja en la actualidad como una de las formas de introducir ADN permanentemente en células somáticas para el tratamiento de enfermedades mediante el uso de la terapia génica. Presentan una elevada estabilidad, además de permitir introducir grandes cantidades de información genética.
- Lipoplexes: El vector de ADN puede ser cubierto por lípidos formando una estructura organizada, como una micela o un liposoma. Cuando la estructura organizada forma un complejo con el ADN entonces se denomina lipoplexe. Hay tres tipos de lípidos: aniónicos, neutros o catiónicos, al ser los aniónicos y los neutros tóxicos los catiónicos son los más utilizados. Éstos, debido a su carga positiva, interaccionan con el ADN, que presenta carga negativa, de tal forma que facilita la encapsulación del ADN en liposomas. El uso de lípidos catiónicos mejoraba la estabilidad de los lipoplexes, además, como resultado de su carga, interactúan también con la membrana celular, permitiendo la endocitosis como la principal vía por la que las células absorben los lipoplexes. Una vez dentro de la célula el endosoma debe de romperse y liberar la carga de ADN si esto no ocurre, es eliminado. Los lipoplexes tiene como desventaja una baja eficiencia en esta etapa por lo que requieren de la ayuda de otros lípidos como desestabilizadores de la membrana del endosoma.
Métodos híbridos
Debido a las deficiencias de muchos de los sistemas de transferencia génica se han desarrollado algunos métodos híbridos que combinan dos o más técnicas. Los virosomas son un ejemplo, y combinan liposomas con el virus inactivado VIH o el virus de la gripe.
- Dendrímeros: Un dendrímero es una macromolécula muy ramificada con forma esférica o variable. Su tamaño está en la escala nanométrica y su superficie puede ser funcional de muchas formas y de ésta derivan muchas de sus propiedades. En particular, es posible construir un dendrímero catiónico, es decir, con carga superficial positiva. De esta forma, interacciona con el ácido nucleico, cargado negativamente, y formar un complejo que puede entrar por endocitosis en la célula.
Células diana
Las células diana se seleccionan en función del tipo de tejido en el que deba expresarse el gen introducido, y deben ser además células con una vida media larga. Igualmente, se debe tener en cuenta si la diana celular es una célula en división o quiescente. Las células diana ideales serían las células madre, puesto que la inserción de un gen en ellas produciría un efecto a largo plazo. Debido a la experiencia en trasplante de médula ósea, una de las dianas celulares más trabajadas son las células madre hematopoyéticas. Otras dianas celulares con las que se ha trabajado son: Linfocitos, células del epitelio respiratorio, Hepatocitos, Fibroblastos dérmicos y células musculares.
Aplicación de la terapia génica en humanos
La aplicación más controversial y polémica de la tecnología de los transgenes es la que respecta a la terapia génica humana, es decir, el tratamiento y alivio de las enfermedades genéticas humanas mediante la adición de genes silvestres exógenos para corregir la función defectuosa de las mutaciones. En los seres humanos puede utilizarse dos tipos básicos de terapia génica: la somática y la germinal.
La terapia génica somática es hasta ahora la que posee disímiles aplicaciones en ya no pocas enfermedades tales como: Fibrosis quística, Enfermedades lisosomales, hipercolesterolemia, melanomas malignos (cáncer), Inmuno Deficiencia Combinada Grave, Distrofia Muscular Duchene, Beta Talasemia, VIH/SIDA, entre otros.
Referencias
- ↑ Durai S, Mani M, Kandavelou K, Wu J, Porteus MH, Chandrasegaran S (2005). "Zinc finger nucleases: custom-designed molecular scissors for genome engineering of plant and mammalian cells". Nucleic Acids Res. 33 (18): 5978–90. doi:10.1093/nar/gki912. PMID 16251401
- ↑ Harwood, Adrian J. Protocols for Gene Analysis. 1st. 31. Totowa, New Jersey: Humana Press, 1994.
Fuentes
- Curso de Introducción a la Biotecnología.Universidad para todos. Revista Biotecnología Aplicada
- Durai S, Mani M, Kandavelou K, Wu J, Porteus MH, Chandrasegaran S (2005). "Zinc finger nucleases: custom-designed molecular scissors for genome engineering of plant and mammalian cells". Nucleic Acids Res. 33 (18): 5978–90. doi:10.1093/nar/gki912. PMID 16251401
- Harwood, Adrian J. Protocols for Gene Analysis. 1st. 31. Totowa, New Jersey: Humana Press, 1994.
- Terapia génica. Disponible en:Monografías
- Biotecnología. Disponible en:Universidad de Granada
- Terapia Génica. Disponible en:The Medical News