Diferencia entre revisiones de «Ácido benzoico»
(Página creada con '{{Desarrollo}} {{Elemento_químico |nombre=Ácido benzoico |imagen=Benzoico02.jpg |nombre,simbolo,numero= C<sub>6</sub>H<sub>5</sub>-COOH |serie_quimica= El '''ácido benzo...') |
|||
| (No se muestran 24 ediciones intermedias de 7 usuarios) | |||
| Línea 1: | Línea 1: | ||
| − | |||
| − | |||
| − | |||
{{Elemento_químico | {{Elemento_químico | ||
|nombre=Ácido benzoico | |nombre=Ácido benzoico | ||
| − | |imagen= | + | |imagen=Ácido_benzoicoP.jpeg |
|nombre,simbolo,numero= C<sub>6</sub>H<sub>5</sub>-COOH | |nombre,simbolo,numero= C<sub>6</sub>H<sub>5</sub>-COOH | ||
| − | |serie_quimica= El '''ácido benzoico''' pertenecen a la familia de los [[ácidos carboxílicos | + | |serie_quimica= El '''ácido benzoico''' pertenecen a la familia de los [[ácido carboxílico|ácidos carboxílicos]] aromáticos. |
| − | + | }} | |
| − | ''' | + | |
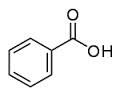
| + | '''Ácido benzoico.''' También llamado '''ácido bencenocarboxílico''', es un [[ácido carboxílico]] aromático que tiene un grupo carboxilo unido a un anillo fenílico su fórmula es C<sub>6</sub>H<sub>5</sub>-COOH. | ||
| + | |||
== Propiedades físicas y químicas== | == Propiedades físicas y químicas== | ||
| + | * Sólido | ||
* Color: incoloro. | * Color: incoloro. | ||
| − | * Olor: | + | * Olor: característico |
| − | + | * Solubilidad en agua: 3,4 g/l a 20 °C | |
| − | * Solubilidad en agua: 3, | + | * Punto de ebullición: 248.85 °C |
| − | * Punto de ebullición: | + | * Punto de fusión: 121.85 °C |
| − | * Punto de fusión: | + | * Masa molar: 122.12 g/mol |
| − | * | ||
| − | |||
| − | |||
== Obtención == | == Obtención == | ||
| − | + | ||
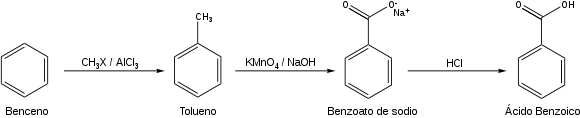
| + | Al ser sintetizado, se obtienen dos productos diferentes al 50% cada uno al 50% pues se suele someter a una reacción oxidación-reducción. La síntesis se realiza haciendo reaccionar el benceno mediante una alquilación Friedel-Crafts con un halogenuro de metilo en presencia de AlCl3 generándose como producto de la reacción [[tolueno]]. | ||
| + | |||
| + | Posteriormente el tolueno se oxida con [[permanganato de potasio]] en medio alcalino dando como productos principales [[benzoato de sodio]] (soluble) y Dióxido de Manganeso (insoluble). Luego de filtrar, se acidifica la fase acuosa y se obtiene el ácido benzoico como un precipitado de color blanco. | ||
| + | |||
| + | Reacción de síntesis del ácido benzoico | ||
| + | |||
| + | [[Archivo:Sistesisbenzoico.png]] | ||
== Aplicaciones == | == Aplicaciones == | ||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | + | * Como conservante utilizado tanto como [[ácido]] como en forma de sus sales de [[sodio]], de [[potasio]] o de [[calcio]]. | |
| + | * Para conservar alimentos con un [[pH]] ácido. | ||
| + | * En la protección contra el moho | ||
| + | * Como producto de partida en la producción de [[ésteres]] del ácido benzoico que se utilizan en perfumería. | ||
| + | * Junto con algunos [[ésteres]] con alcoholes de cadena más larga se utilizan también para ablandecer plásticos como el [[PVC]]. | ||
| + | * El peróxido del ácido benzoico se utiliza como iniciador de reacciones radicalarias. | ||
| + | * Se usa para condimentar el [[tabaco]]. | ||
| + | * Para hacer pastas dentífricas | ||
| + | * Como germicida en [[medicina]] | ||
| + | * Como intermediario en la fabricación de plastificantes y resinas. | ||
| + | * Como preservante en los productos enlatados donde se usa ácido benzoico derivado del [[tolueno]]. | ||
| + | |||
| + | == Reacciones== | ||
| − | + | * A temperaturas por encima de 390ºC, ocurre una reacción de descarboxilación, éste sufre una descomposición en [[dióxido de carbono]] y [[benceno]]. Esta reacción se ha usado desde hace muchos años para producir benceno puro. | |
| − | + | * Cuando se encuentra en presencia de pentacloruro de fósforo, se transforma en cloruro de bencilo, pudiendo éste ser utilizado como derivado para la formación de compuestos [[ésteres]]. | |
| − | |||
| − | + | Ejemplo: | |
| − | + | [[Archivo:Sistesisbenzoico01.png]] | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
== Fuentes == | == Fuentes == | ||
| − | * Requena, L. Vamos a Estudiar Química Orgánica. ([[2001]]). | + | * Requena, L. Vamos a Estudiar Química Orgánica. ([[2001]]). Ediciones Eneva. |
| − | * Rodger W. Griffin "Química orgánica moderna". [[1981]]. | + | * Rodger W. Griffin "Química orgánica moderna". [[1981]]. Editorial Reverté, S.A. |
| − | * Artículo [http://www. | + | * Artículo [http://www.aditivosalimentarios.com/index.php/codigo/210/Acido-benzoico Ácido benzoico]. Disponible en "www.aditivosalimentarios.com". Consultado: 18 de agosto de 2011. |
| − | [[Category: | + | * Artículo [http://quimica.laguia2000.com/quimica-organica/acido-benzoico Ácido benzoico]. Disponible en "quimica.laguia2000.com". Consultado: 18 de agosto de 2011. |
| + | [[Category:Derivados del benceno ]][[Category: Hidrocarburos aromáticos ]][[Category:Elementos químicos]] | ||
última versión al 22:41 7 feb 2021
| ||||||||||
Ácido benzoico. También llamado ácido bencenocarboxílico, es un ácido carboxílico aromático que tiene un grupo carboxilo unido a un anillo fenílico su fórmula es C6H5-COOH.
Propiedades físicas y químicas
- Sólido
- Color: incoloro.
- Olor: característico
- Solubilidad en agua: 3,4 g/l a 20 °C
- Punto de ebullición: 248.85 °C
- Punto de fusión: 121.85 °C
- Masa molar: 122.12 g/mol
Obtención
Al ser sintetizado, se obtienen dos productos diferentes al 50% cada uno al 50% pues se suele someter a una reacción oxidación-reducción. La síntesis se realiza haciendo reaccionar el benceno mediante una alquilación Friedel-Crafts con un halogenuro de metilo en presencia de AlCl3 generándose como producto de la reacción tolueno.
Posteriormente el tolueno se oxida con permanganato de potasio en medio alcalino dando como productos principales benzoato de sodio (soluble) y Dióxido de Manganeso (insoluble). Luego de filtrar, se acidifica la fase acuosa y se obtiene el ácido benzoico como un precipitado de color blanco.
Reacción de síntesis del ácido benzoico
Aplicaciones
- Como conservante utilizado tanto como ácido como en forma de sus sales de sodio, de potasio o de calcio.
- Para conservar alimentos con un pH ácido.
- En la protección contra el moho
- Como producto de partida en la producción de ésteres del ácido benzoico que se utilizan en perfumería.
- Junto con algunos ésteres con alcoholes de cadena más larga se utilizan también para ablandecer plásticos como el PVC.
- El peróxido del ácido benzoico se utiliza como iniciador de reacciones radicalarias.
- Se usa para condimentar el tabaco.
- Para hacer pastas dentífricas
- Como germicida en medicina
- Como intermediario en la fabricación de plastificantes y resinas.
- Como preservante en los productos enlatados donde se usa ácido benzoico derivado del tolueno.
Reacciones
- A temperaturas por encima de 390ºC, ocurre una reacción de descarboxilación, éste sufre una descomposición en dióxido de carbono y benceno. Esta reacción se ha usado desde hace muchos años para producir benceno puro.
- Cuando se encuentra en presencia de pentacloruro de fósforo, se transforma en cloruro de bencilo, pudiendo éste ser utilizado como derivado para la formación de compuestos ésteres.
Ejemplo:
Fuentes
- Requena, L. Vamos a Estudiar Química Orgánica. (2001). Ediciones Eneva.
- Rodger W. Griffin "Química orgánica moderna". 1981. Editorial Reverté, S.A.
- Artículo Ácido benzoico. Disponible en "www.aditivosalimentarios.com". Consultado: 18 de agosto de 2011.
- Artículo Ácido benzoico. Disponible en "quimica.laguia2000.com". Consultado: 18 de agosto de 2011.