Diferencia entre revisiones de «Ácido peroxosulfúrico»
| Línea 1: | Línea 1: | ||
| − | |||
| − | |||
{{Elemento_químico | {{Elemento_químico | ||
|nombre=Ácido peroxosulfúrico | |nombre=Ácido peroxosulfúrico | ||
| Línea 9: | Línea 7: | ||
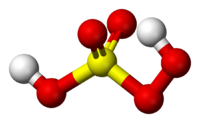
| − | El ''' | + | El '''Ácido peroxosulfúrico''' se presenta en forma de cristales blancos que se funden a 60°C con descomposición. Su fórmula química es S <sub>2</sub>O <sub>8</sub>H <sub>2</sub>. Las disoluciones del ácido persulfúrico presentan reacciones muy semejantes a la del [[agua]] oxigenada: separan yodo del yoduro potásico y descoloran la disolución sulfúrica de añil. En cambio, no descoloran el permanganato potásico. |
. | . | ||
==Antecedentes== | ==Antecedentes== | ||
| − | El ácido peroxosulfúrico fue descrito primero por Heinrich Caro, de quien a veces adquiere el nombre como [[ácido]] de Caro. | + | El [[ácido]] peroxosulfúrico fue descrito primero por Heinrich Caro, de quien a veces adquiere el nombre como [[ácido]] de Caro. |
==Propiedades físicas == | ==Propiedades físicas == | ||
| Línea 30: | Línea 28: | ||
H<sub>2</sub>O<sub>2</sub> + ClSO<sub>2</sub>OH ⇌ H<sub>2</sub>SO<sub>5</sub> + HCl | H<sub>2</sub>O<sub>2</sub> + ClSO<sub>2</sub>OH ⇌ H<sub>2</sub>SO<sub>5</sub> + HCl | ||
| − | Su producción a gran escala es usualmente hecha "in situ" debido a su inestabilidad. De acuerdo a la patente por Martin, el ácido peroxosulfúrico es producido al reaccionar ácido sulfúrico >85% y peróxido de hidrógeno >50%. (Solución piraña). | + | Su producción a gran escala es usualmente hecha "in situ" debido a su inestabilidad. De acuerdo a la patente por Martin, el ácido peroxosulfúrico es producido al reaccionar [[ácido sulfúrico]] >85% y peróxido de hidrógeno >50%. (Solución piraña). |
H<sub>2</sub>O<sub>2</sub> + H<sub>2</sub>SO<sub>4</sub> ⇌ H<sub>2</sub>SO<sub>5</sub> + H<sub>2</sub>O | H<sub>2</sub>O<sub>2</sub> + H<sub>2</sub>SO<sub>4</sub> ⇌ H<sub>2</sub>SO<sub>5</sub> + H<sub>2</sub>O | ||
| Línea 38: | Línea 36: | ||
Las sales de amonio, sodio y potasio del ácido peroxosulfúrico son usadas en la industria de los plásticos como iniciadores de la polimerización, acondicionadores para el [[suelo]] y para aceites decolorantes desodorantes. | Las sales de amonio, sodio y potasio del ácido peroxosulfúrico son usadas en la industria de los plásticos como iniciadores de la polimerización, acondicionadores para el [[suelo]] y para aceites decolorantes desodorantes. | ||
| − | El hidrogenoperoxosulfato de potasio, KHSO<sub>5</sub>, es la sal ácida de potasio del ácido peroxosulfúrico. Es ampliamente utilizado como agente oxidante. | + | El hidrogenoperoxosulfato de [[potasio]], KHSO<sub>5</sub>, es la sal ácida de potasio del ácido peroxosulfúrico. Es ampliamente utilizado como agente oxidante. |
==Peligros== | ==Peligros== | ||
| − | Como con todos los agentes oxidantes fuertes el ácido peroxosulfúrico debe mantenerse alejado de compuestos orgánicos como los éteres y las cetonas por su habilidad de peroxidar el compuesto, creando una molécula altamente inestable como el peróxido de acetona. | + | Como con todos los agentes oxidantes fuertes el ácido peroxosulfúrico debe mantenerse alejado de compuestos orgánicos como los éteres y las cetonas por su habilidad de peroxidar el compuesto, creando una molécula altamente inestable como el peróxido de [[acetona]]. |
== Fuentes== | == Fuentes== | ||
| − | * Martin, P. L. (USA). U.S. Pat. Appl. Publ. (2005), 21 pp. CODEN: USXXCO US 2005031530 A1 20050210 Patent written in English. Application: US 2004-878176 20040628. Priority: US 2003-494009 20030807. CAN 142:179838 AN 2005:122569 CAPLUS | + | * Martin, P. L. (USA). U.S. Pat. Appl. Publ. (2005), 21 pp. CODEN: USXXCO US 2005031530 A1 20050210 Patent written in English. Application: US [[2004]]-878176 20040628. Priority: US 2003-494009 20030807. CAN 142:179838 AN 2005:122569 CAPLUS |
| − | * "Treatment of Softwood Kraft Pulps with Peroxymonosulfate Before Oxygen Delignification. Springer, E. L.; McSweeny, J. D. Tappi Journal (1993), 76, 194-9. | + | * "Treatment of Softwood Kraft Pulps with Peroxymonosulfate Before Oxygen Delignification. Springer, E. L.; McSweeny, J. D. Tappi Journal ([[1993]]), 76, 194-9. |
==Enlaces Externos== | ==Enlaces Externos== | ||
Revisión del 02:36 30 oct 2011
El Ácido peroxosulfúrico se presenta en forma de cristales blancos que se funden a 60°C con descomposición. Su fórmula química es S 2O 8H 2. Las disoluciones del ácido persulfúrico presentan reacciones muy semejantes a la del agua oxigenada: separan yodo del yoduro potásico y descoloran la disolución sulfúrica de añil. En cambio, no descoloran el permanganato potásico.
.
Sumario
Antecedentes
El ácido peroxosulfúrico fue descrito primero por Heinrich Caro, de quien a veces adquiere el nombre como ácido de Caro.
Propiedades físicas
Es un sólido incoloro con un punto de fusión a 45°C. En este ácido elazufre central adopta la geometría tetraédrica.
- Estado de agregación Sólido
- Apariencia Sólido blanco
- Densidad 1700-1800 kg/m3; 1.698,2 g/cm3
- Masa molar 114.04 g/mol g/mol
Síntesis y producción
La preparación a escala de laboratorio comprende la combinación de ácido clorosulfúrico y peróxido de hidrógeno.
H2O2 + ClSO2OH ⇌ H2SO5 + HCl
Su producción a gran escala es usualmente hecha "in situ" debido a su inestabilidad. De acuerdo a la patente por Martin, el ácido peroxosulfúrico es producido al reaccionar ácido sulfúrico >85% y peróxido de hidrógeno >50%. (Solución piraña).
H2O2 + H2SO4 ⇌ H2SO5 + H2O
Usos
El ácido peroxosulfúrico ha sido utilizado en una variedad de aplicaciones limpiadoras y desinfectantes, por ejemplo en tratamiento para piscinas y limpiadores de dentaduras. Las sales metálicas alcalinas del ácido peroxosulfúrico son prometedoras para la delignificación de la madera. Las sales de amonio, sodio y potasio del ácido peroxosulfúrico son usadas en la industria de los plásticos como iniciadores de la polimerización, acondicionadores para el suelo y para aceites decolorantes desodorantes.
El hidrogenoperoxosulfato de potasio, KHSO5, es la sal ácida de potasio del ácido peroxosulfúrico. Es ampliamente utilizado como agente oxidante.
Peligros
Como con todos los agentes oxidantes fuertes el ácido peroxosulfúrico debe mantenerse alejado de compuestos orgánicos como los éteres y las cetonas por su habilidad de peroxidar el compuesto, creando una molécula altamente inestable como el peróxido de acetona.
Fuentes
- Martin, P. L. (USA). U.S. Pat. Appl. Publ. (2005), 21 pp. CODEN: USXXCO US 2005031530 A1 20050210 Patent written in English. Application: US 2004-878176 20040628. Priority: US 2003-494009 20030807. CAN 142:179838 AN 2005:122569 CAPLUS
- "Treatment of Softwood Kraft Pulps with Peroxymonosulfate Before Oxygen Delignification. Springer, E. L.; McSweeny, J. D. Tappi Journal (1993), 76, 194-9.