Diferencia entre revisiones de «Etiología genética»
| Línea 4: | Línea 4: | ||
|tamaño= | |tamaño= | ||
|descripción= | |descripción= | ||
| − | |imagen_de_los_sintomas= | + | |imagen_de_los_sintomas=Etiologia.jpg |
|tamaño2= | |tamaño2= | ||
|descripción2= | |descripción2= | ||
| Línea 14: | Línea 14: | ||
|vacuna= | |vacuna= | ||
}} | }} | ||
| − | ==[[ | + | '''Etiología Genética''', causa de este trastorno es una [[mutación]] en el [[gen]] que codifica para el receptor 3 del factor de crecimiento [[fibroblástico]] (FGFR3), localizado en el cromosoma. |
| + | |||
| + | ==Herencia genética== | ||
| + | |||
| + | Existen dos mutaciones posibles que afectan a este gen: G1138A y G1138C. Ambas son puntuales, donde dos pares de bases complementarias del ADN se intercambian: | ||
| + | Mutación G1138A: en el nucleótido número 1138, la [[guanina]] es sustituida por [[adenina]]. En el 98% de los casos de acondroplasia, se sufre esta mutación. Mutación G1138C: tiene lugar el cambio de guanina por citosina, también en el nucleótido 1138. La frecuencia de esta alteración es mucho menor, apenas en el 2% de los casos. En ambas situaciones, la repercusión en la cadena aminoacídica de la proteína FGFR3 es la misma: el cambio del aminoácido arginina por una glicina. | ||
| − | |||
| − | |||
Dicha mutación puede darse de dos formas distintas: por herencia autosómica dominante, cuando hay antecedentes familiares de enfermedad (alrededor del 10% de los casos) y por una mutación de novo, con padres sanos (es la causa más frecuente, hasta en el 90% de los pacientes). | Dicha mutación puede darse de dos formas distintas: por herencia autosómica dominante, cuando hay antecedentes familiares de enfermedad (alrededor del 10% de los casos) y por una mutación de novo, con padres sanos (es la causa más frecuente, hasta en el 90% de los pacientes). | ||
==La HSRC no clásica == | ==La HSRC no clásica == | ||
| − | Es clínicamente similar al síndrome de [[ovarios poliquísticos]] y sólo se hace su diagnóstico diferencial por la medición de 17 hidroxiprogesterona en los primeros días de un ciclo menstrual espontáneo o inducido. Valores de 2 ng/ml o menores descartan el cuadro. Entre 2 y 5 ng/ml se debe efectuar una prueba de estimulación con ACTH para lo cual se inyecta un bolo intravenoso de ACTH en dosis de 0,1 mg, 0,25 mg a 1,0 mg no existiendo diferencia en la respuesta suprarrenal al usar cualquiera de estas dosis. Valores de 17 hidroxidrogesterona menores de 10 ng/ml 30 a 60 minutos postestimulación descartan el cuadro | + | |
| + | Es clínicamente similar al síndrome de [[ovarios poliquísticos]] y sólo se hace su diagnóstico diferencial por la medición de 17 hidroxiprogesterona en los primeros días de un ciclo menstrual espontáneo o inducido. Valores de 2 ng/ml o menores descartan el cuadro. | ||
| + | |||
| + | Entre 2 y 5 ng/ml se debe efectuar una prueba de estimulación con ACTH para lo cual se inyecta un bolo intravenoso de ACTH en dosis de 0,1 mg, 0,25 mg a 1,0 mg no existiendo diferencia en la respuesta suprarrenal al usar cualquiera de estas dosis. Valores de 17 hidroxidrogesterona menores de 10 ng/ml 30 a 60 minutos postestimulación descartan el cuadro. | ||
==La frecuencia del síndrome== | ==La frecuencia del síndrome== | ||
| − | Es escasa no superando el 1 a 2% de los [[hiperandrogenismo]] en mujeres caucásicas. La terapia con corticoesteroides en dosis bajas, en este caso betametasona 0,6 mg diarios, corrige el déficit de cortisol y disminuye la secreción de ACTH y por lo tanto la de andrógenos suprarrenales. Sin embargo, a pesar de que es posible detectar bajas de la 17 hidroxiprogesterona y de la androstenediona la elevación por largo tiempo de estos andrógenos producen una alteración del eje hipotálamo-hipófisis-ovarios que impiden que la administración de corticoides por si sola sea capaz de restablecer la ovulación y los ciclos menstruales regulares. Es, por lo tanto, necesario recurrir a la inducción de la ovulación con los métodos clásicos | + | |
| + | Es escasa no superando el 1 a 2% de los [[hiperandrogenismo]] en mujeres caucásicas. La terapia con corticoesteroides en dosis bajas, en este caso betametasona 0,6 mg diarios, corrige el déficit de cortisol y disminuye la secreción de ACTH y por lo tanto la de andrógenos suprarrenales. Sin embargo, a pesar de que es posible detectar bajas de la 17 hidroxiprogesterona y de la androstenediona la elevación por largo tiempo de estos andrógenos producen una alteración del eje hipotálamo-hipófisis-ovarios que impiden que la administración de corticoides por si sola sea capaz de restablecer la ovulación y los ciclos menstruales regulares. Es, por lo tanto, necesario recurrir a la inducción de la ovulación con los métodos clásicos. | ||
En esta paciente 2 ciclos de inducción con clomifeno desde el día 5 al 9 del ciclo fracasaron en lograr su objetivo. La inducción con HMG (Humegón®) 150 UI durante 8 días provocó ovulación múltiple y el desarrollo de embarazo gemelar doble. Desafortunadamente, el embarazo terminó | En esta paciente 2 ciclos de inducción con clomifeno desde el día 5 al 9 del ciclo fracasaron en lograr su objetivo. La inducción con HMG (Humegón®) 150 UI durante 8 días provocó ovulación múltiple y el desarrollo de embarazo gemelar doble. Desafortunadamente, el embarazo terminó | ||
| Línea 32: | Línea 39: | ||
folículo y de que disminuye el riesgo de embarazo múltiple. | folículo y de que disminuye el riesgo de embarazo múltiple. | ||
| − | == Fuentes == | + | == Fuentes == |
| − | *Sectorial Municipal de Salud Guane. | + | |
| − | *http://noticias.cibercuba.com/2008/08/14/2607/ | + | * Sectorial Municipal de Salud Guane. |
| − | Portal de Cibercuba] | + | * [http://noticias.cibercuba.com/2008/08/14/2607/ Portal de Cibercuba] |
| − | *http://www.telepinar.co.cu/index.php/200808144088/Tecnologia/ | + | * [http://www.telepinar.co.cu/index.php/200808144088/Tecnologia/Portal de Telepinar] |
| − | Portal de Telepinar | + | * [http://www.cubaheadlines.com/es/2008/08/14/12901/ Portal de noticias de cubaheadlines] |
| − | *http://www.cubaheadlines.com/es/2008/08/14/12901/ | + | * [http://es.wikipedia.org/wiki/Acondroplasia/ Wikipedia] |
| − | Portal de noticias de cubaheadlines | + | |
| − | *http://es.wikipedia.org/wiki/Acondroplasia | ||
[[Category:Ciencias_Médicas]] | [[Category:Ciencias_Médicas]] | ||
[[Category:Enfermedades]] | [[Category:Enfermedades]] | ||
Revisión del 15:30 21 mar 2014
| ||||||
Etiología Genética, causa de este trastorno es una mutación en el gen que codifica para el receptor 3 del factor de crecimiento fibroblástico (FGFR3), localizado en el cromosoma.
Herencia genética
Existen dos mutaciones posibles que afectan a este gen: G1138A y G1138C. Ambas son puntuales, donde dos pares de bases complementarias del ADN se intercambian: Mutación G1138A: en el nucleótido número 1138, la guanina es sustituida por adenina. En el 98% de los casos de acondroplasia, se sufre esta mutación. Mutación G1138C: tiene lugar el cambio de guanina por citosina, también en el nucleótido 1138. La frecuencia de esta alteración es mucho menor, apenas en el 2% de los casos. En ambas situaciones, la repercusión en la cadena aminoacídica de la proteína FGFR3 es la misma: el cambio del aminoácido arginina por una glicina.
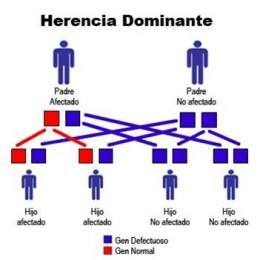
Dicha mutación puede darse de dos formas distintas: por herencia autosómica dominante, cuando hay antecedentes familiares de enfermedad (alrededor del 10% de los casos) y por una mutación de novo, con padres sanos (es la causa más frecuente, hasta en el 90% de los pacientes).
La HSRC no clásica
Es clínicamente similar al síndrome de ovarios poliquísticos y sólo se hace su diagnóstico diferencial por la medición de 17 hidroxiprogesterona en los primeros días de un ciclo menstrual espontáneo o inducido. Valores de 2 ng/ml o menores descartan el cuadro.
Entre 2 y 5 ng/ml se debe efectuar una prueba de estimulación con ACTH para lo cual se inyecta un bolo intravenoso de ACTH en dosis de 0,1 mg, 0,25 mg a 1,0 mg no existiendo diferencia en la respuesta suprarrenal al usar cualquiera de estas dosis. Valores de 17 hidroxidrogesterona menores de 10 ng/ml 30 a 60 minutos postestimulación descartan el cuadro.
La frecuencia del síndrome
Es escasa no superando el 1 a 2% de los hiperandrogenismo en mujeres caucásicas. La terapia con corticoesteroides en dosis bajas, en este caso betametasona 0,6 mg diarios, corrige el déficit de cortisol y disminuye la secreción de ACTH y por lo tanto la de andrógenos suprarrenales. Sin embargo, a pesar de que es posible detectar bajas de la 17 hidroxiprogesterona y de la androstenediona la elevación por largo tiempo de estos andrógenos producen una alteración del eje hipotálamo-hipófisis-ovarios que impiden que la administración de corticoides por si sola sea capaz de restablecer la ovulación y los ciclos menstruales regulares. Es, por lo tanto, necesario recurrir a la inducción de la ovulación con los métodos clásicos.
En esta paciente 2 ciclos de inducción con clomifeno desde el día 5 al 9 del ciclo fracasaron en lograr su objetivo. La inducción con HMG (Humegón®) 150 UI durante 8 días provocó ovulación múltiple y el desarrollo de embarazo gemelar doble. Desafortunadamente, el embarazo terminó en aborto espontáneo a las 17 semanas sin que se pudiera precisar su causa.
Tres meses después de su aborto y habiendo continuando la terapia con betametasona se estimuló nuevamente con gonadotrofinas, esta vez con dosis bajas de FSH pura (Humegón® 50 UI) que se elevó a 75 U: después de 7 días de no haber respuesta folicular. Este último procedimiento, pese a prolongar el período de crecimiento folicular y que en ocasiones significa mayor consumo de gonodotrofinas tiene la gran ventaja de que generalmente produce el crecimiento de un solo folículo y de que disminuye el riesgo de embarazo múltiple.
Fuentes
- Sectorial Municipal de Salud Guane.
- Portal de Cibercuba
- de Telepinar
- Portal de noticias de cubaheadlines
- Wikipedia