Fósforo (sustancia)
| ||||||||||||||||||||||||||||||||||||||||||||||
Fósforo. El segundo elemento del grupo V, es mucho más abundante que el nitrógeno. Se encuentra en unos 200 minerales distintos, muchas veces en forma de fosfatos simples o mixtos.
Sumario
Historia
El fósforo fue descubierto en 1669 por el alquimista Hennig Brand de Hamburgo, el primer hombre conocido que descubre un elemento. Buscando la piedra filosofal Brand destiló una mezcla de arena y orina evaporada, y obtuvo un cuerpo que tenía la propiedad de lucir en la oscuridad. Se le llamó «fósforo de Brand», para distinguirlo de otros materiales luminosos denominados también fósforo.
Durante un siglo se vino obteniendo esta substancia exclusivamente de la orina, hasta que en 1771 Scheeele la produjo de huesos calcinados. Más tarde, la palabra «fósforo» se reservó para designar esta substancia, cuando Lavoisier demostró que era un elemento e investigó algunos de los productos formados al quemarlo en el aire.
Boyle, por su parte parece que también descubrió el fósforo y comunicó el hallazgo a un industrial alemán ,G. Hatkwits, el cual industrializó su obtención en Londres.
Estado natural
El fósforo se encuentra fundamentalemente en el mineral apatito, Ca3(PO4)2, que forma parte de las rocas fosfatadas. Como los compuestos del nitrógeno, los de fósforo son constituyentes esenciales de la materia viva; por ejemplo, los huesos contienen alrededor del 60 % de fosfato de calcio. Otra fuente de fósforo es de origen animal, producido por excrementos de aves en las costas chilenas y peruanas.
El fósforo, en forma de fosfatos disueltos en el agua de los mares, es de gran importancia para la vida de los seres que viven en ellos. Se calcula en una concentración media de 0,00007 g/litro. En la superficie es menor, y con la profundidad aumenta gradualmente, hasta estabilizarse. El océano Atlántico ofrece porcentajes más bajos.
Tambien se encuentra en la mayoría de los alimentos, por ejemplo:
- Frutos secos: girasol, sésamo, pistacho, almendras.
- Legumbres: soja, alubias, garbanzos y lentejas.
- Cereales: trigo, copos de avena, arroz integral, levadura, salvado de trigo.
Formas alotrópicas
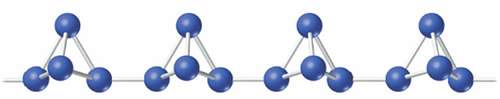
Existen distintas formas de fósforo sólido, pero solo tienen importancia las formas blanca y roja. El fósforo blanco consta de moléculas tetrédricas discretas, P4.
La estructura del fósforo rojo no está bien determinada, pero hay testimonios de que se trata de un polímero formado por cadenas de tetraedros P4 ligados.
A la temperatura ordinaria, la modificación estable es la roja, pues por su estructura de elevada polimerización es menos volátil, menos activa y menos soluble ( sobre todo, en los disolventes no polares) que la blanca. Esta última forma debe manejarse con cuidado, porque se inflama espontáneamente en el aire y es muy tóxica.
Obtención
El fósforo elemental se obtiene reduciendo el fosfato de calcio con coque en presencia de arena. La ecuación representativa del proceso es:
Ca3(PO4)2(s) + 3SiO2(s) + 5C(s) = 3CaSiO3 + 5CO(g) + P2(g)
La reacción se realiza a temperatura elevada, por lo cual el fósforo se desprende en estado de gas, que se solidifica haciéndolo pasar a través de agua. Esta condensación no solo sirve para separar el fósforo del monóxido de carbono, sino también para impedir que el aire lo vuelva a oxidar.
Compuestos
El fósforo blanco es muy activo y se combina con la mayor parte de los elementos. Arde en el oxígeno con una llama blanca muy brillante produciendo nubes de óxido de fósforo (V) sólido. Aproximadamente a 50ºC se produce su inflamación.
Expuesto al aire se oxida lentamente y produce el fenómeno de la fosforescencia, que se observa en la oscuridad. Dado que esta reacción es exotérmica, se produce con bastante frecuencia la inflamación espontánea del fósforo blanco, por lo que suele guardarse bajo el agua.
Parece ser que la fosforescencia se debe a la oxidación lenta del fósforo blanco a óxido de fósforo (III) emitiéndose energía en forma luminiscente. El fósforo blanco se transforma lentamente en rojo por la acción de la luz por lo que es necesario guardarlo en la oscuridad.
El fósforo rojo está constituído por pequeños cristales y alguna otra modificación amorfa y tiene la apariencia de un polvo rojo. Se obtiene cuando se calienta fósforo blanco a 250ºC en ausencia de aire.
Se sublima dando el mismo vapor que el fósforo blanco y cuando se condensa el vapor se obtiene fósforo blanco. Su temperatura de inflamación ronda los 400ºC.
No se disuelve en los mismos disolventes que el fósforo blanco ni produce fosforescencia ni resulta venenoso cuando se encuentra puro.
En realidad el fósforo rojo es fósforo violeta que se obtiene por disolución de fósforo blanco en plomo fundido.
El fósforo rojo es menos reactivo que el blanco, y no se oxida fácilmente con el aire. La mayoría de los compuestos fosforados son trivalentes o pentavalentes. El fósforo se combina fácilmente con el oxígeno para formar óxidos, de los que son más importantes el trióxido de fósforo (P2O3) y el pentóxido de fósforo (P2O3).
El trióxido de fósforo, sólido cristalino blanco, se usa como agente reductor. Es delicuescente, esto es, es disuelto por la humedad del aire. El vapor es tóxico.
El pentóxido de fósforo, blanco, delicuescente, sólido amorfo, sublima a 250ºC. Reacciona con el agua para formar ácido fosfórico y se usa como agente desecante. El fósforo forma hidruros con el hidrógeno ; es importante el hidruro de fósforo o fosfina PH3, que es comparable al amoníaco (NH3), el hidruro de nitrógeno.
Aplicaciones
Los compuestos comerciales más importantes de fósforo son el ácido fosfórico y sus sales, llamadas fosfatos. La mayoría de los compuestos fosforados se usan como fertilizantes.
Los compuestos fosforados se usan también para aclarar las soluciones de azúcar de remolacha y en aleaciones especiales como bronces al fósforo.
El fósforo blanco se usa en la elaboración de veneno para las ratas, insecticidas y en la industria pirotécnica y el fósforo rojo se usa para fabricar cerillas.
En los fósforos ordinarios la cabeza se compone de una mezcla combustible de azufre y clorato de potasio bañada en sulfuro de fósforo que se inflama por el calor producido en la fricción y produce a su vez la inflamación de la mezcla combustible.
Fuentes
- Bouant, E. Nuevo Diccionario de Química. Ed. Espasa y Cía. Editores, Barcelona (1888).
- Babor, J. A. y Ibarz A., J. Química General Moderna. Ed. Marín, S. A, Barcelona (1983).
- Sharp, D.W.A. (1989). Diccionario de Química Miall. Ed. Alhambra, Madrid (1989).
- Asimov, I. La búsqueda de los elementos. Ed. RBA editores, Barcelona (1993).
- Priesner, Cl. Y Figala K. (eds.). Alquimia. Enciclopedia de una ciencia hermética. Ed. Herder, Barcelona (2001).
- Agell y Agell, J. Tratado de Análisis Químico. Ed. Imprenta de José Ortega, Barcelona (1910).
- Sabalitschka, T. Análisis Químico-toxicológico. Ed. José Montesó, Barcelona (1926).
- Gómez P., J. R. Manual de análisis química. Ed. Moya y Plaza, Madrid (1870).
- Novellón, V. Origen de cosas cotidianas en la cocina. http://www.fut.es/~vne/cosas_cotidianas_index.htm
- Real Academia Española. Diccionario de la lengua española. Ed. Espasa, Madrid (2001)