Calor específico
| ||||||
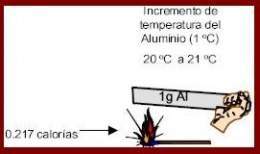
Calor específico. Es la cantidad de calor necesaria para elevar en un grado kelvin o Celsius la temperatura de un gramo de sustancia.
Sumario
Introducción
La capacidad calorífica de un cuerpo o sustancia esta definida por la cantidad de calor que hay que suministrar a toda la masa o cantidad total de moles de una sustancia determinada para elevar su temperatura en un grado kelvin o Celsius, se representa por la letra C y la define la siguiente ecuación diferencial:
- C = dQ/dT
Si esa capacidad calorífica se aplica por unidad de masa o mol entonces estaremos en presencia de otra magnitud física la capacidad calorífica específica o calor específico, que expresa la cantidad de calor que se necesita suministrar para elevar en un grado la temperatura de un gramo de una sustancia cualquiera, se representa por la letra c y esta definida por la siguiente ecuación:
- c = C/m
Donde:
- C es la capacidad calorífica
- m es la masa de la sustancia
Por supuesto que los valores de c estarán en dependencia de la temperatura a que se encuentre la sustancia inicialmente.
Términos usados
- Calor específico molar: usado especialmente en química, la unidad de la cantidad de sustancia usada es el mol, el cual es un cierto número de moléculas o átomos de la sustancia.
- Calor específico másico: cuando la unidad de la cantidad de sustancia se expresa en unidad de masa.
Algunas consideraciones
- El calor específico de una sustancia puede ser negativo, positivo, nulo o infinito, dependiendo del proceso que experimente el sistema durante la transferencia de calor. Sólo tiene un valor definido para un proceso determinado. Por lo tanto, la capacidad calorífica de un sistema depende tanto de la naturaleza del sistema, como del proceso particular que el sistema experimenta.
- La capacidad calorífica en un proceso durante el cual el sistema se somete a una presión hidrostática externa constante, se denomina capacidad calorífica a presión constante y se representa por Cp. El valor de Cp para un sistema determinado depende de la presión y de la temperatura.
- Si el sistema se mantiene a volumen constante mientras se le suministra calor, la capacidad calorífica correspondiente se denomina capacidad calorífica a volumen constante y se representa por Cv.
- Debido a las grandes tensiones que se producen cuando se calienta un sólido o un líquido al que se le impide su expansión, las determinaciones experimentales de Cv en sólidos y líquidos son difíciles y por ello se mide generalmente la magnitud Cp.
La cantidad total de calor que fluye en un sistema en cualquier proceso viene dado por:
Q = ti∫tf CdT
Dentro de un intervalo de temperaturas en el cual C puede considerarse constante:
Q = C (Tf - Ti) = mc (Tf - Ti)
- Cuanto mayor es la capacidad calorífica del sistema, menor es la variación de temperatura para un flujo determinado y, en realidad, haciendo la capacidad calorífica lo suficientemente grande, la variación de temperatura puede hacerse tan pequeña como se desee. Un sistema cuya capacidad calorífica es muy grande se denomina fuente térmica y se caracteriza por el hecho de que se le puede entregar o quitar cualquier cantidad de calor sin que se produzca en él una variación de temperatura apreciable.
- Una forma de obtener una fuente térmica es tomar una gran masa de sustancia (por ejemplo, el mar o un río pueden considerarse como tal).
Unidades
Las cantidades de calor se miden en unidades térmicas, cuyas denominaciones y significados son los siguientes:
- Caloría (cal): Cantidad de calor necesario para elevar en un grado centígrado la temperatura de un gramo de agua pura.
- Kilocaloría (Kcal): Cantidad de calor necesario para elevar en un grado centígrado la temperatura de un kilogramo de agua pura.
- BTU (Unidad Térmica Británica): Cantidad de calor necesario para elevar en un grado Fahrenheit, la temperatura de una libra de agua pura.
- Joule: Sistema Internacional de Unidades.
El calor específico por tanto sería: en caloría por gramo y por kelvin (cal·g-1·K-1), en BTU por libra y grado Fahrenheit (BTU ·lb-1·F-1) y julios por kilogramo y por kelvin (J·kg-1·K-1) para el Sistema Internacional de Unidades.
Enlace relacionado
Enlaces externos
Fuentes
- Ing.Santibañez María C.Tecnología Azucarera.
- Profesor en línea