Diferencia entre revisiones de «Ecuación de Clausius-Clapeyron»
(Página creada con '{{Definición |nombre= Ecuación de Clausius-Clapeyron |imagen= |tamaño= |concepto= Se emplea para determinar la variación de la presión de saturación con la temperatura...') |
|||
| Línea 21: | Línea 21: | ||
donde [[image:CC2.png]] | donde [[image:CC2.png]] | ||
| − | + | es la pendiente de dicha curva, ΔH es el calor latente o [[entalpía]] del cambio de fase y ΔV es el [[volumen]]. | |
| − | o [[entalpía]] | ||
| − | del cambio de fase y ΔV es el [[volumen]]. | ||
| Línea 32: | Línea 30: | ||
dos fases [[image:Eqn5-11.gif]] , y cualquier variación infinitesimal que suponga un | dos fases [[image:Eqn5-11.gif]] , y cualquier variación infinitesimal que suponga un | ||
desplazamiento sobre la curva de equilibrio implica que[[image:Eqn5-12.gif]] . O lo que es lo mismo,[[image:Eqn5-13.gif]] , y reagrupando términos [[image:Eqn5-14.gif]] . | desplazamiento sobre la curva de equilibrio implica que[[image:Eqn5-12.gif]] . O lo que es lo mismo,[[image:Eqn5-13.gif]] , y reagrupando términos [[image:Eqn5-14.gif]] . | ||
| + | |||
Por otra parte si se considera que en un cambio de | Por otra parte si se considera que en un cambio de | ||
fase reversible a T y P constantes [[image:Eqn5-15.gif]] , se tiene que | fase reversible a T y P constantes [[image:Eqn5-15.gif]] , se tiene que | ||
[[image:Eqn5-16.gif]] | [[image:Eqn5-16.gif]] | ||
| − | + | Ecuación de Clapeyron | |
| − | El | + | |
| − | nombre de ecuación | + | El nombre de ecuación de Clapeyron esen |
| − | de Clapeyron esen | ||
honor al ingeniero y físico francés E. | honor al ingeniero y físico francés E. | ||
[[Clapeyron]] ([[1799]]-[[1864]]). Ésta es una importante relación | [[Clapeyron]] ([[1799]]-[[1864]]). Ésta es una importante relación | ||
| Línea 52: | Línea 50: | ||
==Consideraciones sobre la ecuación de Clapeyron== | ==Consideraciones sobre la ecuación de Clapeyron== | ||
*En un cambio de fase líquido-vapor, tanto ΔH como ΔV son positivos, por tanto la | *En un cambio de fase líquido-vapor, tanto ΔH como ΔV son positivos, por tanto la | ||
| − | + | pendiente de la línea de equilibrio líquido-vapor es positiva. Lo mismo sucede con la línea sólido-vapor. | |
| − | *En un cambio de fase | + | *En un cambio de fase sólido-líquido, ΔH es positivo y en general ΔV también, por lo tanto la pendiente de esta línea también será positiva. Existen sin embargo algunas excepciones como el [[H2O]],[[Ga]] o [[Bi]] debido a una disminución de volumen que sufren estos componentes al fundirse, en estos casos la pendiente de la línea de equilibrio [[sólido]]-[[líquido]] será negativa. |
| − | + | *En el cambio de fase sólido-líquido ΔV es mucho menor que en los cambios de fase sólido-gas o líquido-gas. Por esta razón la pendiente en el primer caso es mucho mayor que en los | |
| − | + | últimos. | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | *En el cambio de fase sólido-líquido ΔV es mucho | ||
| − | |||
| − | |||
| − | |||
===Aplicación de la ecuación de Clapeyron a distintos cambios de fase.=== | ===Aplicación de la ecuación de Clapeyron a distintos cambios de fase.=== | ||
===Equilibrio líquido-vapor y sólido-vapor=== | ===Equilibrio líquido-vapor y sólido-vapor=== | ||
| − | En estos dos casos el V | + | En estos dos casos el V molar del gas es mucho mayor que el del líquido o que el del sólido |
| − | molar del gas es mucho mayor que el del líquido o que el del sólido | ||
por lo que puede hacerse la aproximación [[image:Eqn5-17.gif]] | por lo que puede hacerse la aproximación [[image:Eqn5-17.gif]] | ||
| − | Si además se hace la suposición de que el gas se | + | Si además se hace la suposición de que el gas se comporta como gas ideal, la ecuación de Clapeyron se transforma en: |
| − | comporta como gas ideal, la ecuación de Clapeyron se transforma en: | ||
[[image:Eqn5-18.gif]] | [[image:Eqn5-18.gif]] | ||
| Línea 76: | Línea 64: | ||
expresar como [[image:Eqn5-19.gif]] llamada ecuación de | expresar como [[image:Eqn5-19.gif]] llamada ecuación de | ||
[[Clausius]] [[Clapeyron]] | [[Clausius]] [[Clapeyron]] | ||
| + | |||
Si el | Si el | ||
rango de temperatura analizado es pequeño, se puede suponer que ΔH | rango de temperatura analizado es pequeño, se puede suponer que ΔH | ||
| Línea 81: | Línea 70: | ||
la línea de equilibrio, y por tanto: [[image:Eqn5-20.gif]]ec. | la línea de equilibrio, y por tanto: [[image:Eqn5-20.gif]]ec. | ||
de Clausius-Clapeyron integrada [[image:Eqn5-21.gif]] | de Clausius-Clapeyron integrada [[image:Eqn5-21.gif]] | ||
| + | |||
===Equilibrio sólido-líquido=== | ===Equilibrio sólido-líquido=== | ||
| Línea 91: | Línea 81: | ||
este caso la variación de la P de equilibrio cuando cambia la T se | este caso la variación de la P de equilibrio cuando cambia la T se | ||
obtiene directamente a partir de la ecuación de Clapeyron:[[image:Eqn5-22.gif]] | obtiene directamente a partir de la ecuación de Clapeyron:[[image:Eqn5-22.gif]] | ||
| + | |||
Los | Los | ||
valores de ΔHfus | valores de ΔHfus | ||
| Línea 112: | Línea 103: | ||
de despreciar el volumen molar del sólido o del líquido frente al | de despreciar el volumen molar del sólido o del líquido frente al | ||
del gas, que además se supone de comportamiento ideal. | del gas, que además se supone de comportamiento ideal. | ||
| + | |||
Esta ecuación puede ser usada para | Esta ecuación puede ser usada para | ||
predecir dónde se va a dar una transición de fase. Por ejemplo, la | predecir dónde se va a dar una transición de fase. Por ejemplo, la | ||
| Línea 123: | Línea 115: | ||
Asumiendo que la variación de la temperatura es pequeña, y que por | Asumiendo que la variación de la temperatura es pequeña, y que por | ||
tanto podemos considerar constante tanto el calor latente de fusión | tanto podemos considerar constante tanto el calor latente de fusión | ||
| − | como los volúmenes específicos | + | como los volúmenes específicos. |
| + | |||
| + | ==Véase También== | ||
| + | *[[Presión de vapor]] | ||
==Fuente== | ==Fuente== | ||
| − | *Requena | + | *Requena Rodríguez, Alberto; Zuñiga Roman, José. Química Física. 1ra Edición. 2007. |
| − | Rodríguez, Alberto; Zuñiga Roman, José. Química Física. 1ra Edición. 2007. | ||
*MORCILLO RUBIO, Jesús; SENENT PÉREZ y otros: Química Física. 2da Edición.2000 | *MORCILLO RUBIO, Jesús; SENENT PÉREZ y otros: Química Física. 2da Edición.2000 | ||
| − | [[Categoría:Química_física | + | [[Categoría:Química_física]] |
Revisión del 14:44 8 mar 2012
| ||||
La ecuación Clausius-Clapeyron es una forma de caracterizar el cambio
de fases entre un líquido y el sólido.
En un diagrama P-T (presión-temperatura),
la línea que separa ambos estados se conoce como curva de
coexistencia. La relación de Clausius-Clapeyron da la
pendiente de dicha curva. Matemáticamente se puede expresar como:
![]()
donde ![]() es la pendiente de dicha curva, ΔH es el calor latente o entalpía del cambio de fase y ΔV es el volumen.
es la pendiente de dicha curva, ΔH es el calor latente o entalpía del cambio de fase y ΔV es el volumen.
Sumario
Deducción
Consideremos un punto cualquiera sobre una línea de
equilibrio entre dos las fases, que llamaremos α y β. La condición
para que exista equilibrio de fases es que:![]() , pero para una sustancia pura
, pero para una sustancia pura ![]() , por tanto en un punto sobre la curva de equilibrio de
dos fases
, por tanto en un punto sobre la curva de equilibrio de
dos fases ![]() , y cualquier variación infinitesimal que suponga un
desplazamiento sobre la curva de equilibrio implica que
, y cualquier variación infinitesimal que suponga un
desplazamiento sobre la curva de equilibrio implica que![]() . O lo que es lo mismo,
. O lo que es lo mismo,![]() , y reagrupando términos
, y reagrupando términos ![]() .
.
Por otra parte si se considera que en un cambio de
fase reversible a T y P constantes ![]() , se tiene que
, se tiene que
![]()
Ecuación de Clapeyron
El nombre de ecuación de Clapeyron esen honor al ingeniero y físico francés E. Clapeyron (1799-1864). Ésta es una importante relación termodinámica pues permite determinar la entalpía de vaporización a una temperatura determinada midiendo simplemente la pendiente de la curva de saturación en un diagrama P-T y el volumen específico del líquido saturado y el vapor saturado a la temperatura dada.
La ecuación de Clapeyron permite calcular la pendiente de una línea de equilibrio entre dos fases en el diagrama de fases P-T de un sistema de un componente.
Consideraciones sobre la ecuación de Clapeyron
- En un cambio de fase líquido-vapor, tanto ΔH como ΔV son positivos, por tanto la
pendiente de la línea de equilibrio líquido-vapor es positiva. Lo mismo sucede con la línea sólido-vapor.
- En un cambio de fase sólido-líquido, ΔH es positivo y en general ΔV también, por lo tanto la pendiente de esta línea también será positiva. Existen sin embargo algunas excepciones como el H2O,Ga o Bi debido a una disminución de volumen que sufren estos componentes al fundirse, en estos casos la pendiente de la línea de equilibrio sólido-líquido será negativa.
- En el cambio de fase sólido-líquido ΔV es mucho menor que en los cambios de fase sólido-gas o líquido-gas. Por esta razón la pendiente en el primer caso es mucho mayor que en los
últimos.
Aplicación de la ecuación de Clapeyron a distintos cambios de fase.
Equilibrio líquido-vapor y sólido-vapor
En estos dos casos el V molar del gas es mucho mayor que el del líquido o que el del sólido
por lo que puede hacerse la aproximación ![]() Si además se hace la suposición de que el gas se comporta como gas ideal, la ecuación de Clapeyron se transforma en:
Si además se hace la suposición de que el gas se comporta como gas ideal, la ecuación de Clapeyron se transforma en:
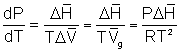
Esta ecuación se suele
expresar como ![]() llamada ecuación de
Clausius Clapeyron
llamada ecuación de
Clausius Clapeyron
Si el
rango de temperatura analizado es pequeño, se puede suponer que ΔH
es constante a lo largo de
la línea de equilibrio, y por tanto: ![]() ec.
de Clausius-Clapeyron integrada
ec.
de Clausius-Clapeyron integrada 
Equilibrio sólido-líquido
Para estudiar los
equilibrios de fase sólido-líquido, no puede
utilizarse la ecuación de Clausius-Clapeyron ya que para obtenerla
se han realizado una serie de aproximaciones válidas cuando una de
las fases que interviene es gas.
En
este caso la variación de la P de equilibrio cuando cambia la T se
obtiene directamente a partir de la ecuación de Clapeyron:
Los valores de ΔHfus y de ΔVfus varían a lo largo de la curva de equilibrio sólido-líquido, las funciones de estado H y V son funciones de T y P, y por lo tanto lo son también ΔHfus y de ΔVfus. Sin embargo la elevada pendiente de esta línea en el diagrama P-T implica que a menos que P cambie en una cantidad considerable, la variación de T será muy pequeña, por tanto podemos tomar como aproximación:
Aplicación
La ecuación de Clausius-Clapeyron sóloes aplicable para obtener la presión de vapor de un sólido o un líquido a una cierta temperatura, conocido otro punto de equilibrio entre las fases. Esto es así porque para llegar a esta expresión desde la ec. de Clapeyron se hace la aproximación de despreciar el volumen molar del sólido o del líquido frente al del gas, que además se supone de comportamiento ideal.
Esta ecuación puede ser usada para predecir dónde se va a dar una transición de fase. Por ejemplo, la ecuación de Clausius-Clapeyron se usa frecuentemente para explicar el patinaje sobre hielo: el patinador (de unos 70 kg), con la presión de sus cuchillas, aumenta localmente la presión sobre el hielo, lo cual lleva a éste a fundirse. ¿Funciona dicha explicación? Si T=−2 °C, podemos emplear la ecuación de Clausius-Clapeyron para ver qué presión es necesaria para fundir el hielo a dicha temperatura. Asumiendo que la variación de la temperatura es pequeña, y que por tanto podemos considerar constante tanto el calor latente de fusión como los volúmenes específicos.
Véase También
Fuente
- Requena Rodríguez, Alberto; Zuñiga Roman, José. Química Física. 1ra Edición. 2007.
- MORCILLO RUBIO, Jesús; SENENT PÉREZ y otros: Química Física. 2da Edición.2000