Energía Térmica
| ||||||
Energía térmica. Se denomina a la energía liberada en forma de calor y puede ser obtenida de la naturaleza o del sol, mediante una reacción exotérmica, como la combustión de algún combustible, por una combustión nuclear de fisión u de fusión. Asimismo podemos aprovechar la energía geotérmica y energía fotovoltaica.
La energía térmica se debe al movimiento de las partículas que constituyen la materia. Un cuerpo a baja temperatura tendrá menos energía térmica que otro que esté a mayor temperatura.
Sumario
- 1 Calor y transferencia de energía
- 2 Movimiento molecular y temperatura
- 3 Equilibrio térmico y escalas de temperatura
- 4 Cantidad de calor transferida en intervalos térmicos
- 5 Determinación de la capacidad calorífica especifica
- 6 Cantidad de calor transferida en los cambios de estado
- 7 Otros efectos de calor sobre los cuerpos
- 8 Dilatación de los sólidos
- 9 Dilatación de los líquidos
- 10 Dilatación de los Gases
- 11 Equivalencia entre energía mecánica y energía térmica
- 12 Experimento de Joule
- 13 Degradación de la energía
- 14 Procesos irreversibles
- 15 Maquinas térmicas
- 16 Fuente
Calor y transferencia de energía
La energía mecánica es la que se intercambia cuando se realiza trabajo. Sin embargo, existen otros intercambios de energía que no se pueden cuantificar por medio del trabajo.
El intercambio de energía térmica o calorífica se cuantifica por el calor, y este, por las variaciones de temperatura.
- El trabajo y el calor son procesos mediante los cuales se intercambia energía.
- Energía, trabajo y calor se miden en las mismas unidades.
Movimiento molecular y temperatura
De acuerdo con la teoría cinética de la materia, esta se compone de partículas (átomos, moléculas o iones) que están en continuo movimiento y que, por tanto, poseen energía cinética.
Cuando un cuerpo se encuentra a una temperatura elevada, sus moléculas se mueven muy deprisa, es decir, tienen mucha energía cinética, y cuando esta a baja temperatura, sus moléculas se mueven más despacio: tienen menos energía cinética. La energía térmica se relaciona con la energía cinética que tienen las partículas del cuerpo y con su temperatura.
Equilibrio térmico y escalas de temperatura
Al poner en contacto dos cuerpos que tienen temperaturas diferentes, ambos acaban alcanzando la misma temperatura al cabo de cierto tiempo. Cuando esto ocurre, se dice que los dos cuerpos han alcanzado et equilibrio térmico.
- Dos cuerpos en contacto a la misma temperatura están en equilibrio térmico.
- El calor es la transferencia de energía que tiene lugar desde un cuerpo caliente (a mayor temperatura) a otro frío (a menor temperatura) al ponerlos en contacto.
El calor es la transferencia de energía que tiene lugar desde un cuerpo caliente (a mayor temperatura) a otro frío (a menor temperatura) al ponerlos en contacto.
Los termómetros funcionan gracias al equilibrio térmico. Cuando introducimos un termómetro dentro de un frasco con agua, llega un momento en el que el mercurio del termómetro y el agua del frasco alcanzan el equilibrio térmico, y la temperatura del agua es la misma que la que indica la escala del termómetro, que ha sido previamente calibrado.
La temperatura es la magnitud que miden los termómetros.
- En la escala centígrada o Celsius se toman como puntos fijos el
punto de fusión del agua, 0 °C, y su punto de ebullición, 100 °C.
- La escala Kelvin o escala absoluta de temperaturas conserva el tamaño del grado centígrado, pero el punto de fusión del agua es 273 K, y su punto de ebullición, 373 K.
La relación numérica entre ambas escalas es:
T (K) = t (°C) + 273
Cantidad de calor transferida en intervalos térmicos
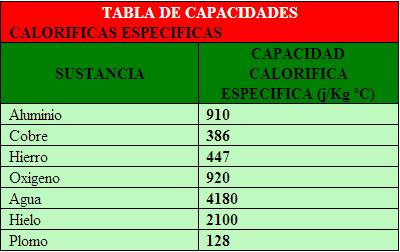
La capacidad calorífica especifica o calor especifico, c, de un cuerpo es la energía necesaria para elevar un grado la temperatura de 1 kg de masa de dicho cuerpo. Sus unidades son el J/kg °C o el J/kg K.
Tomadas a 1 atm de presión y a 25 0C.
En la tabla de capacidades caloríficas específicas aparece la correspondiente al agua liquida: 4180 J/kg °C. Esto quiere decir que son necesarios 4180 J para elevar 1 °C la temperatura de 1 kg de agua liquida.
Determinación de la capacidad calorífica especifica
Los calorímetros se utilizan para aislar del ambiente las sustancias y realizar, de esta forma, experimentos en los que se produce una variación de temperatura. Un calorímetro consta de un recipiente que contiene agua y que esta provisto de una tapadera con dos orificios, a través de los cuales se introduce un agitador y un termómetro. El recipiente esta envuelto por un aislante térmico que reduce al mínimo las pérdidas de energía al exterior.
Los calorímetros se utilizan para determinar la capacidad calorífica específica de las sustancias.
Si se mezcla en un calorímetro una cierta cantidad de plomo, , a una temperatura, con una determinada cantidad de agua, , a una temperatura , la mezcla alcanza al poco tiempo el equilibrio térmico a una temperatura t (temperatura de equilibrio). El balance de energía es: energía cedida por = energía absorbida por el plomo “se enfría” et agua “se calienta”
Ejemplo
Un calorímetro como el de la fotografía contiene 0,450 kg de agua a 24°C. Se introduce un bloque de plomo de 0,1 kg a una temperatura de 97,5 °C. Una vez alcanzado el equilibrio térmico, la temperatura del conjunto es de 24,5 °C. Calcula la capacidad calorífica específica del plomo.
Solución. La energía térmica transferida por el bloque de plomo al agua ha hecho posible que la temperatura de esta se eleve 0,5 °C. La expresión: permite calcular la cantidad de energía ganada por el agua:
Q = 0,450 kg • 4 180 J/kg °C • (24,5 °C - 24 °C) = 940,5 J
Por tanto, la cantidad de energía cedida por el plomo es: Como el balance de energía en el equilibrio térmico es:
Energía cedida por el plomo = energía absorbida par el agua Igualamos ambas expresiones y despejamos la capacidad calorífica específica del plomo: 0,1 kg . - (97’5 °C – 24’5 °C) = 940’5 J = 128’84 J/kg °C
La diferencia entre este valor y el que aparece en la tabla de la pagina anterior puede deberse a [as perdidas inevitables de energía térmica que tienen lugar en el calorímetro.
Cantidad de calor transferida en los cambios de estado
Como acabamos de ver, cuando se produce una transferencia de energía térmica entre dos cuerpos, ambos experimentan una variación de temperatura que depende de la capacidad calorífica específica de cada uno de ellos. Sin embargo, esto no sucede cuando tiene lugar un cambio de estado en uno o en ambos cuerpos. La experiencia nos dice que, mientras tiene lugar un cambio de estado, la temperatura permanece constante.
El cambio de estado de las sustancias consiste en un intercambio de energía. Pueden darse los siguientes casos:
Si se produce cuando se suministra energía al cuerpo, tenemos:
Fusión. Cambio de estado de sólido a líquido.
Vaporización. Cambio de estado de líquido a gas.
Sublimación. Cambio de estado de sólido directamente a gas.
Si se produce cuando el cuerpo o sistema cede energía al ambiente, tenemos:
Solidificación. Cambio de estado de líquido a sólido. La temperatura a la que se solidifica un líquido coincide con su punto de fusión.
Condensación. Cambia de estado de gas a líquido.
Sublimación inversa. Cambio de estado de gas directamente a sólido.
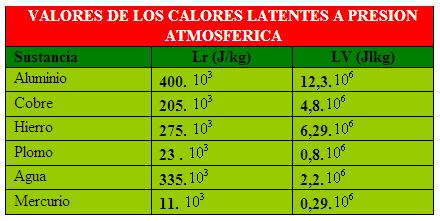
El calor latente de cambio de estado, L, es la cantidad de energía térmica que se transfiere a un kilogramo de masa de una sustancia pura para cambiar de estado, a una presión determinada y a la temperatura de cambio de estado.
En el caso de la fusión: En esta expresión, es el valor latente de fusión, que es igual al de solidificación. La diferencia reside en que para fundir un material le comunicamos energía, mientras que, cuando se solidifica, se desprende energía en forma de calor.
En el caso de la vaporización:
En esta expresión, L, es el calor latente de vaporización, que es igual al valor de condensación o licuación. La diferencia estriba en que para vaporizar el material hay que comunicarle energía, mientras que, al condensarse o licuarse, se desprende energía
El calor latente se establece a la temperatura a la que se produce el cambio de estado, y aquella depende de la presión y de la naturaleza de la sustancia de que se trate. Por ello, en las tablas donde se recogen los dates de calores I latentes figura siempre la presión a la que se ha realizado la medición
Otros efectos de calor sobre los cuerpos
Cuando un cuerpo recibe energía térmica, no solo se incrementa la temperatura, sino que experimenta también un fenómeno diferente: la dilatación. Es un hecho comprobado que todos los cuerpos se dilatan al calentarse, en muy pocas excepciones (por ejemplo, el agua entre los 0º C y los 4 º C). Los gases se dilatan más que los líquidos, y estos, a su vez, más que los sólidos.
Dilatación de los sólidos
La dilatación de los sólidos puede ser lineal, superficial o cúbica, según tenga lugar en una, dos o tres dimensiones.
En los sólidos homogéneos e isótopos (aquellos que las características físicas de los cuales no dependen de la dirección) se verifican los fenómenos siguientes:
- La dilatación de una dimensión determinada es proporcional al valor inicial de esta dimensión.
- Las dilataciones lineales, superficiales y cúbicas son proporcionales al aumento de temperatura que experimentan los cuerpos.
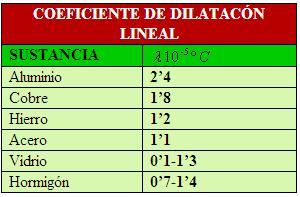
La dilatación lineal es el aumento de la longitud que experimenta un cuerpo al ser calentado.
Donde Lo es la longitud del cuerpo a 0 º C, t es la temperatura a la que se calienta; Lt es la longitud resultante a la temperatura t, y Landa es el coeficiente de dilatación lineal, que es el alargamiento que experimenta la unidad de longitud del sólido, medida a 0ºC, cuando la temperatura se eleva 1 ºC. Esto último es un valor característico de la sustancia.
La dilatación superficial es el aumento de superficie que experimenta un cuerpo por efecto del calor.
Donde So es la superficie del cuerpo a 0ºC; t es la temperatura a la que se calienta, St es la superficie resultante a la temperatura t, y Beta es el coeficiente de dilatación superficial, que es el aumento que experimenta la unidad de superficie de un cuerpo, medida a 0ºC cuando la temperatura se eleva 1ºC.
La dilatación cúbica es el aumento de volumen que experimenta un sólido al elevar su la temperatura.
Donde ,Vo es el volumen del cuerpo a 0ºC, t es la temperatura a la que se calienta; Vt es el volumen resultante a la temperatura t, y ,Ganma es el coeficiente de dilatación cúbica, que es al aumento que experimenta la unidad de volumen de un cuerpo, medida a 0ºC, cuando la temperatura se eleva 1 ºC.
La unidad en que se expresan los tres coeficientes es: C(-1)
Una lámina metálica con un orificio, a la que se le incrementa la temperatura, el área del orificio es dilatada en la misma proporción que la superficie que la rodea.
Cuando diseñan grandes estructuras, como edificios, puentes, hay que tener en cuenta la dilatación que experimentan cuando varia la temperatura.
Algunos puentes son aproximadamente 1 metro mas largos en el verano que en el invierno. Si este hecho no se tuviera en cuenta, la acción de las fuerzas de dilatación haría que el puente se curvara.
Dilatación de los líquidos
Resulta más difícil medir la dilatación por efecto de la temperatura en los cuerpos líquidos que en los sólidos, ya que en aquellos se dilata el liquido con el recipiente que el contiene. Por esta razón, se suele hablar de dilatación aparente de los líquidos.
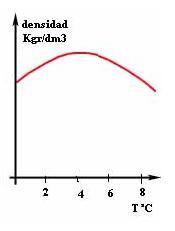
La dilatación aparente de un líquido es la dilatación real o propia del liquido menos la que experimenta el volumen del recipiente que el contiene. Dilatación anómala del agua
En la grafica del margen se puede observar que la dilatación del agua es distinta a la de otras sustancias. El agua tiene una dilatación anómala. A partir de los 4º C se dilata como los otros líquidos a medida que se aumenta la temperatura. No obstante, entre los 0º C y los 4º C, en lugar de dilatarse se contrae. Por lo tanto, el agua llega a un volumen mínimo y a la máxima densidad a los 4º C.
Dilatación de los Gases
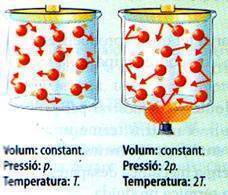
Los gases se dilatan mucho menos que los sólidos y los líquidos. Las variables de un gas son la presión, el volumen y la temperatura.
Anteriormente, habíamos analizado la relación constante que hay entre la presión, el volumen de una masa determinada de gas cuando la temperatura se mantiene constante (Ley de Boyle).
Presión .Volumen=constante P.V=cte
A continuación, estudiaremos la influencia que tiene la variación de la temperatura en una masa de un gas constante.
Al hacer variar la temperatura de un gas, se pueden producir los siguientes fenómenos:
- El volumen varía si mantenemos la presión constante.
- La presión varía manteniendo el volumen constante.
En el segundo caso no se trata de una dilatación, ya que no hay un aumento de volumen, aunque si una perturbación causada por el incremento de la temperatura.
Supongamos un gas encerrado en un recipiente, la cara del cual puede desplazarse mediante un embolo móvil. Si se duplica la temperatura por el calentamiento del gas con una fuente de calor, se aumenta la energía cinética de las partículas, que, al tener mas velocidad, duplican el numero de veces que cada una por separado golpea las paredes del recipiente, aumentando, así, el volumen hasta que la presión interior se iguala a la exterior (atmosférica) y se mantiene constante.
Si la presión se mantiene constante, se conseguirá duplicar el volumen inicial al aumentar al doble de la temperatura.
Supongamos un gas cerrado en un recipiente, el volumen del cual se mantiene constante. Si se duplica la temperatura por la presencia de una fuente de calor, la energía cinética de las partículas aumenta y se duplica el número de veces que estas golpean las paredes del recipiente. Si el volumen se mantiene constante, la presión se duplica.
Equivalencia entre energía mecánica y energía térmica
Cuando los científicos del siglo XVIII se referían a la energía, la relacionaban únicamente con el calor y empleaban la unidad denominada caloría, que todavía se continua utilizando.
El físico y químico británico Joseph Black (1728-1799) va a definir la caloria (cal) como “cantidad de calor necesario para elevar 1ºC la temperatura de 1 gr de Agua”.
Esta definición se refiere al calentamiento por una fuente de calor, como la combustión de un material.
Experimentalmente sabemos que la combustión no es la única fuente de energía térmica que existe, ya que también se puede producir este tipo de energía a partir de la mecánica. (Golpeando dos metales por ejemplo, batiendo el agua con una batidora, doblando un alambre repetidas veces, ) Ahora bien, lo importante no es constatar el hecho que se produce energía térmica a partir de la energía mecánica, sino descubrir cual es la relación cuantitativa que hay entre trabajo y calor.
En 1845, el físico inglés James Prescott Joule va a demostrar por primera vez la equivalencia entre calor y trabajo. Va a llevar a término una serie de experimentos para comprobar que, cuando una cierta cantidad de energía mecánica se consume en un sistema, la energía mecánica desaparecida es exactamente igual que la energía térmica producida.
Experimento de Joule
Joule diseñó un dispositivo como el que se representa en el dibujo, con el que demostró la equivalencia entre calor y trabajo. Dejó caer unos pesos desde una altura determinada. Los pesos, al precipitarse, provocan el movimiento de unas paletas dentro de un recipiente lleno de agua y aislado térmicamente del exterior. El científico ingles dedujo el calor producido en el líquido midiendo el aumento de temperatura.. Repitió el experimento 7 veces y hizo las correspondientes medidas de la variación de temperatura del agua por el efecto del giro de las paletas.
A raíz de este experimento, Joule estableció, que la relación entre la cantidad de trabajo y calor producida es invariable. Si el trabajo y el calor se miden en las mismas unidades, esta relación puede expresarse de la forma siguiente:
W=Q
Este resultado se conoce como equivalencia mecánica del calor. Joule demostró que siempre que se hace la misma cantidad de trabajo sobre un sistema, se obtendrá la misma cantidad de calor, independientemente que el trabajo sea de origen mecánico, eléctrico o químico.
Observa que la relación encontrada por Joule, es otra manera de enunciar el principio de conservación de la energía total, que incluye el calor como otra forma de transferencia de energía:
La cantidad de energía total de un sistema se mantiene constante.
Joule estableció la equivalencia entre Calorías y Julios:
1 cal = 4’18 Julios 1 Julio = 0’24 cal
Degradación de la energía
Aunque la equivalencia entre la energía mecánica y la energía térmica es completa, hay una diferencia esencial entre las trasformaciones en los dos sentidos. Así es posible transformar fácilmente toda la energía mecánica en energía térmica.
Un ejemplo muy frecuente es el trabajo hecho por las fuerzas de rozamiento que se convierten íntegramente en calor. En cambio, generalmente mediante una máquina térmica nada más se aprovecha una fracción de la energía térmica disponible en forma de energía mecánica. Por esta razón se puede afirmar que la energía se degrada.
Si dos formas de energía, A y B, se intercambian por completo, se puede asegurar que ambas son del mismo grado, es decir, que tienen la misma calidad. La calidad o el grado de una energía es la disponibilidad que tiene para hacer un trabajo.
Si es posible convertir íntegramente la forma A de energía en la forma B, pero el proceso inverso no se consigue por completo, cabe deducir que la forma A tiene mas grado de energía, es decir, es de mas calidad que la B.
La energía de mas grado que se transforma en energía térmica ya no puede recuperarse de nuevo totalmente comonuna energía de mas grado, este fenómeno recibe el nombre de degradación de la energía.
La energía se degrada al adoptar una forma que resulta menos util para hacer trabajo. En todos los procesos naturales en que hay una transferencia de calor, la energía disponible para hacer el trabajo disminuye.
El rendimiento de cualquier transformación energética es:
Es fácil convertir completamente el trabajo mecánico o la energía interna de un sistema en calor sin ningún otro cambio, no obstante, es imposible extraer calor o energía interna de un sistema y convertirla del todo en trabajo mecánico sin ningún cambio adicional.
Procesos irreversibles
Paralelamente a la conversión de calor en trabajo, existen otros procesos consecuentes con la relación de Joule, W=Q, que no tienen lugar en la naturaleza, como el paso de calor de manera espontánea de un cuerpo frió a otro.
Si el movimiento de todas las partículas materiales del universo se invirtiera en un instante determinado, el curso de la naturaleza se invertiría también para siempre.
Aquellos procesos que cumplen el principio de conservación de la energía, pero que los procesos inversos de los cuales nunca ocurre, se llaman procesos irreversibles.
Maquinas térmicas
Las máquinas térmicas disponen de un foco caliente (caldera) y de un foco frío (condensador o refrigerante). Mediante una cantidad de calor transferida por el foco caliente, la máquina produce un trabajo, W, y reintegra una cantidad de calor al foco frío. La diferencia, constituye la energía útil; por lo tanto, el rendimiento teórico de una máquina térmica es:
Podemos deducir que:
Una máquina térmica es un dispositivo que puede transformar energía térmica en otras formas de energía, como la eléctrica o la mecánica.
La Máquina de vapor:
Una máquina de vapor transforma en energía mecánica la energía calorífica que se desprende en las reacciones de combustión de los combustibles (madera, carbón, petróleo). Esta energía es debida al vapor que se produce al calentar el agua hasta la ebullición en un recipiente cerrado (caldera).
En una máquina convencional de vapor se calienta agua a presión muy elevada hasta que se vaporiza, lo que produce vapor de agua a una temperatura muy alta. La presión de vapor anterior empuja un muelle conectada a una biela, de manera que el movimiento de ésta hace gira un volante, es decir, el vapor se expande contra el pistón, y así hace un trabajo. El vapor escapa después a una temperatura mucho mas baja y se enfría hasta que se condensa. El agua es bombeada e introducida de nuevo en la caldera, donde vuelve a calentarse.
Hoy en día la maquina de vapor se emplea para producir energía eléctrica (por ejemplo, en las centrales térmicas).
El motor de combustión interna
En una máquina de vapor, el combustible se quema fuera del motor para calentar el agua y produce el vapor que mueve el dispositivo.
El avance que supone el motor de combustión interna de cuatro tiempos, consiste en el hecho de que el gas se comprime antes de su combustión, lo cual no solo aumenta el rendimiento, sino que además, reduce el consumo de combustible, que suele ser un producto derivado del petróleo, por lo que disminuye la energía calorífica disipada al medio ambiente y, por eso, la contaminación.
- Admisión: El pistón, al desplazarse hacia abajo, aspira una mezcal de aire y combustible.
- Comprensión: El pistón se mueve hacia arriba y comprime la mezcla para la ignición.
- Explosión: Al quemarse la mezcla, los gases se expanden y desplazan el pistón hacia arriba.
- Expulsión: el movimiento del pistón hacia arriba empuja los gases hacia afuera del cilindro.
De estos cuatro tiempos, nada mas el tercero proporciona potencia.
En una central térmica, se produce energía eléctrica a partir de la energía térmica que se desprende en la combustión de combustibles como el carbón, el petróleo….En esta transformación, parte de la energía térmica se disipa al medio ambiente..