Espectrometría
| ||||||
Espectrometría. Es la técnica espectroscópica para tasar la concentración o la cantidad de especies determinadas. En estos casos, el instrumento que realiza tales medidas es un espectrómetro o espectrógrafo.
Sumario
Historia
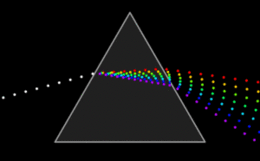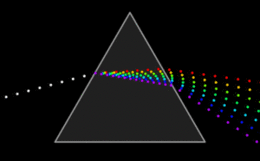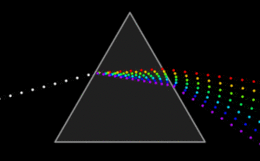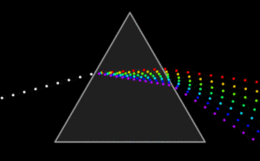
La espectroscopía surgió con el estudio de la interacción entre la radiación y la materia como función de la longitud de onda (λ). En un principio se refería al uso de la luz visible dispersada según su longitud de onda, por ejemplo por un prisma. Más tarde el concepto se amplió enormemente para comprender cualquier medida en función de la longitud de onda o de la frecuencia. Por tanto, la espectroscopía puede referirse a interacciones con partículas de radiación o a una respuesta a un campo alternante o frecuencia variante (ν). Una extensión adicional del alcance de la definición añadió la energía (E) como variable, al establecerse la relación E=hν para los fotones. Un gráfico de la respuesta como función de la longitud de onda (o más comúnmente la frecuencia) se conoce como espectro.
Principios de la espectrofotometría
En la espectrofotometría se aprovecha la absorción de radiación electromagnética en la zona del ultravioleta y visible del espectro. La muestra absorbe parte de la radiación incidente en este espectro y promueve la transición del analito hacia un estado excitado, transmitiendo un haz de menor energía radiante. En esta técnica se mide la cantidad de luz absorbida como función de la longitud de onda utilizada. La absorción de las radiaciones ultravioletas, visibles e infrarrojas depende de la estructura de las moléculas, y es característica de cada sustancia química.
La espectrofotometría ultravioleta-visible utiliza ases de radiación del espectro electromagnético, en el rango UV de 180 a 380 nm, y en el de la luz visible de 380 a 780 nm, por lo que es de gran utilidad para caracterizar los materiales en la región ultravioleta y visible del espectro.
Ley de Lambert
La ley de Lambert trata sobre la iluminancia de una superficie situada a una cierta distancia de una fuente de luz. Determina que la iluminación producida por una fuente luminosa sobre una superficie es directamente proporcional a la intensidad de la fuente y al coseno del si ángulo que forma la normal a la superficie con la dirección de los rayos de luz y es inversamente proporcional al cuadrado de la distancia a dicha fuente.
Ley de Lambert-Beer
La ley de Lambert-Beer afirma que la cantidad de luz absorbida por un cuerpo depende de la concentración en la solución.
Por ejemplo, en un vaso de vidrio tenemos agua con azúcar disuelta y en otro vaso tenemos la misma cantidad de agua pero con mayor cantidad de azúcar en solución. El detector es una celda fotoeléctrica, y lo que se mide es la concentración de la solución de azúcar.
Según la ley de Beer, si hiciéramos que un rayo de luz atravesara el primer vaso, la cantidad de luz que saldría del otro lado sería mayor que si repitiéramos esto en el segundo, ya que en este último las ondas electromagnéticas chocan contra un mayor número de átomos o/y moléculas y son absorbidos por estos.
Ley de Bouguer-Beer-Lambert
Una ley muy importante es la de Bouguer-Beer-Lambert (también conocida como ley de Lambert Bouguer y Beer), la cual es solo una combinación de las citadas anteriormente.
Transmitancia y absorción de las radiaciones
Por las leyes mencionadas anteriormente, al hacer pasar una cantidad de fotones o de radiaciones hay una pérdida que se expresa con la ecuación:
It/Io=T-kdc''
donde It es la intensidad de luz que sale de la cubeta y que va a llegar a la celda fotoeléctrica (llamada radiación o intensidad transmitida); Io es la intensidad con la que sale al atravesar la celda (radiación intensidad incidente), y la relación entre ambas (T) es la transmitancia.
En el exponente, el signo negativo se debe a que la energía radiante decrece a medida que el recorrido aumenta. El superíndice k es la capacidad de la muestra para la captación del haz del campo electromagnético, d es la longitud de la cubeta de espectrofotometría que recorre la radiación, y c es la concentración del soluto en la muestra ya ubicada en la cubeta.
Usos
La espectrometría a menudo se usa en física y química analítica para la identificación de sustancias mediante el espectro emitido o absorbido por las mismas.
La espectrometría también se usa mucho en astronomía y detección remota. La mayoría de los telescopios grandes tienen espectrómetros, que son usados para medir la composición química y propiedades físicas de los objetos astronómicos, o para medir sus velocidades a partir del efecto Doppler de sus líneas espectrales.
Aplicaciones
Las aplicaciones principales son:
- Determinar la cantidad de concentración en una solución de algún compuesto utilizando las fórmulas ya mencionadas;
- Ayudar en la determinación de estructuras moleculares;
- La identificación de unidades estructurales específicas, ya que estas tienen distintos tipos de absorbancia (grupos funcionales o isomerías);
- Determinar constantes de disociación de indicadores ácido-base.
Tipos de espectrofotometría
- Espectrofotometría de absorción molecular VIS-UV. 13,
- Espectrofotometría de absorción molecular IR.15.
- Espectrofotometría de absorción y emisión atómica.
- Espectrofotometría con atomizadores electrotérmicos.
- Espectrofotometría de emisión con plasma.
- Espectrofotometría de fluorescencia molecular.
Véase también
- Espectrofotometría
- Colorimetría
- Colorímetro
- Espectrofotómetro
- Espectrofluorimetría
- Química
- Ensayo químico
- Espectro electromagnético