Estados de agregación
| ||||||
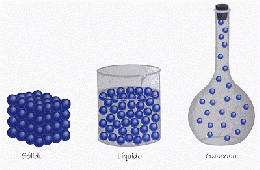
La materia existe en tres estados físicos: sólido, líquido y gaseoso.
Sumario
Tipos de estados
Sólido
Las sustancias en estado sólido ocupan un volumen definido y normalmente tienen forma y firmeza determinadas, la movilidad de las partículas que las constituyen en casi nula, existiendo una gran cohesión.
En este estado las partículas solamente pueden moverse vibrando u oscilando alrededor de posiciones fijas, pero no pueden moverse trasladándose libremente a lo largo del sólido.
Las partículas se disponen de forma ordenada, con una regularidad espacial geométrica, que da lugar a diversas estructuras cristalinas.
Algunos ejemplos del estado sólido son una piedra, un martillo,un tronco,una silla, etc
Líquido
Un líquido también ocupa un volumen fijo, pero es necesario colocarlo en un recipiente. El volumen del líquido tomará la forma del recipiente en que se coloca; la movilidad y las fuerzas de cohesión de sus partículas son intermedias.
En los líquidos el movimiento es desordenado, pero existen asociaciones de varias partículas que, como si fueran una, se mueven al unísono. Al aumentar la temperatura aumenta la movilidad de las partículas (su energía).
Algunos ejemplos del estado líquido son agua, refresco, la sangre, el jugo, la leche, el mercurio, etc.
Gaseoso
Un gas no tiene forma ni volumen definidos, por lo que se almacena en un recipiente cerrado. El gas tiende a ocupar todo el volumen del recipiente en que está confinado y sus partículas poseen gran energía cinética, presentando movimientos desordenados.
Al aumentar la temperatura las partículas se mueven más de prisa y chocan con más energía contra las paredes del recipiente, por lo que aumenta la presión.
Algunos ejemplos de este estado son el agua al evaporarse, el hidrógeno, el dióxido de carbono
Existe un cuarto estado llamado plasma. Este estado se considera formado por gases como el helio en forma iónica, existe en las estrellas y el fuego es un ejemplo típico.
Cambios de estado
La sustancias pueden cambiar de un estado a otro si las condiciones cambian. Estas condiciones son presión y temperatura.
Los cambios de estado son:
- Fusión: Cambio que sufren las sustancias al pasar del estado sólido al líquido al incrementarse el calor.
Ejemplos: Fundición del acero para hacer láminas, tubos, etc. Fundición de los metales empleados en una aleación para acuñar una moneda; fusión de un plástico para moldearlo, etcétera.
- Evaporación: Cambio que se experimenta cuando un líquido pasa al estado de vapor o gas por incremento de calor.
Ejemplos: Eliminación de agua en una meladura para obtener azúcar; eliminación de un solvente orgánico para obtener un sólido cristalino; disminución de un volumen de líquido concentrando así un sólido disuelto o llevándolo inclusive hasta el secado. Sustancias como el alcohol, la acetona, la gasolina, etc., en contacto con el medio ambiente experimentan una vaporización sin que se les suministre calor, el fenómeno ocurre debido a la baja presión existente sobre ellas.
- Sublimación: Es el paso del estado sólido al gaseoso o al de vapor sin pasar por el estado líquido, necesitándose calor.
Ejemplos: Pocas sustancias se conocen con este comportamiento y entre ellas están el yodo, el arsénico, el alcanfor, la naftalina, el dióxido de carbono y algunas más de tipo orgánico.
El "hielo seco" es dióxido de carbono sólido y al contacto con el medio ambiente pasa directamente al estado gaseoso. Una pastilla aromatizante sufre este fenómeno.
El cambio contrario, de gas o vapor a sólido, también se llama sublimación o degradación.
- Solidificación: Este cambio requiere de eliminar calor y ocurre cuando un líquido pasa al estado sólido.
Ejemplos: Una vez moldeado un plástico, fundida una pieza de acero o de alguna aleación, es necesario esperar su solidificación para obtener la pieza deseada en estado sólido.
- Condensación: Es el paso del estado de vapor al estado líquido. Este cambio también supone la eliminación de calor.
Ejemplos: Al eliminar el agua de una meladura o el solvente de una solución, es necesario recuperar esos líquidos, como están en estado de vapor y a temperatura elevada, se les hace enfriar y condensar, en estado liquido se recuperan y ocupan menor volumen.
- Licuefacción: Es el paso del estado gaseoso al estado líquido. Además de eliminar calor debe aumentarse la presión para conseguir el cambio.
Ejemplos: La obtención de aire líquido o de alguno de sus componentes, nitrógeno y oxígeno, que son gases y se pueden tener en estado liquido.
La temperatura es tan baja (por ejemplo -196 °C) que las propiedades de algunas sustancias cambian espectacularmente: las flores se solidifican y se quiebran, un pollo se endurece de tal forma que puede romperse con un martillo, el mercurio se solidifica, etcétera.
La diferencia entre un vapor y un gas es que el vapor se condensa y el gas se licua.
De interés
- La evaporación y la ebullición son dos formas de producir el cambio de líquido a gas o vapor. La evaporación ocurre en la superficie del líquido. La ebullición ocurre en toda la masa del líquido.
- Cada sustancia pura tiene su propia temperatura de fusión denominada punto de fusión, en éste punto la presión de vapor del sólido equilibra a la presión de vapor del líquido.
- Cada sustancia pura tiene su propia temperatura de ebullición denominada punto de ebullición, en éste punto la presión de vapor del líquido equilibra a la presión exterior.
Véase también
Enlaces externos
Fuentes
- Babor, Joseph A. y Aznárez, José Ibarz. Química General Moderna. Instituto Cubano del libro. La Habana. 1969.
- Plane, Robert A. y Sienko, Michel J. Química. Colección Ciencia Técnica Aguiar.
- De Galiano Mingot, Tomás.Pequeño Larousse de Ciencias Técnicas