Diferencia entre revisiones de «Gas ideal»
(→Fuentes) |
(→Fuentes) |
||
| Línea 37: | Línea 37: | ||
#Fiares, V. M. Termodinámica. Editorial Revolucionaria. La Habana. 1991. | #Fiares, V. M. Termodinámica. Editorial Revolucionaria. La Habana. 1991. | ||
#Kirillin, V. A., Sichev, V. V., Sheindlin, A. E. Termodinámica Técnica. Editorial MIR. Moscú. 1986. | #Kirillin, V. A., Sichev, V. V., Sheindlin, A. E. Termodinámica Técnica. Editorial MIR. Moscú. 1986. | ||
| − | #Saveliev, I. V. Curso de Física | + | #Saveliev, I. V. Curso de Física General. En tres tomos. Editorial MIR. Moscú. 1984. |
#Yavorski, B. M. , Detlaf, A. M. Prontuario de Física. Editorial MIR. Moscú. 1983. | #Yavorski, B. M. , Detlaf, A. M. Prontuario de Física. Editorial MIR. Moscú. 1983. | ||
[[Category:Termodinámica]] | [[Category:Termodinámica]] | ||
Revisión del 11:21 20 sep 2011
El gas ideal o perfecto es un patrón de la Termodinámica que sirve para establecer reglas de comportamiento de los gases.
| ||||
Sumario
Condiciones que debe cumplir el gas ideal
- Ocupa el volumen del recipiente que lo contiene.
- Las moléculas del gas ideal se mueven individualmente y al azar en todas direcciones.
- Al chocar entre sí y con las paredes del recipiente, las moléculas del gas ideal se comportan como esferas perfectamente elásticas.
- Los choque son instantáneos.
Leyes del gas ideal
Ecuación de Clapeyron
Para una masa dada del gas ideal, la razón del producto de los valores numéricos de la presión (p) y el volumen (V) a la temperatura absoluta (T) es una magnitud constante.
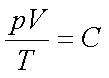
El valor numérico de la constante de los gases C depende de las unidades de medida que se elijan para p, V y T
Ecuación de Estado del gas ideal
La ecuación que describe normalmente la relación entre la presión, el volumen, la temperatura y la cantidad (en moles) de un gas ideal es:
Donde: P= Presión absoluta (medida en atmósferas) V= Volumen (en esta ecuación el volumen se expresa en litros) n= Moles de Gas R= Constante universal de los gases ideales T= Temperatura absoluta
Ley de Boyle – Mariotte
Si se mantiene la temperatura constante (proceso isotérmico) de una cantidad dada de gas ideal, cuando se aumenta la presión del gas ideal, su volumen disminuye en la misma proporción.
Ley de Gay-Lussac
Si se mantiene la presión constante (proceso isobárico) sobre una cantidad dada de gas ideal, el volumen del gas aumentará en la misma proporción en que aumente su temperatura absoluta:

Ley de Charles
Si se mantiene el volumen constante (proceso isocorico), la presión de un gas aumenta en la misma proporción en la que aumenta su temperatura absoluta:

Véa también
Fuentes
- Fiares, V. M. Termodinámica. Editorial Revolucionaria. La Habana. 1991.
- Kirillin, V. A., Sichev, V. V., Sheindlin, A. E. Termodinámica Técnica. Editorial MIR. Moscú. 1986.
- Saveliev, I. V. Curso de Física General. En tres tomos. Editorial MIR. Moscú. 1984.
- Yavorski, B. M. , Detlaf, A. M. Prontuario de Física. Editorial MIR. Moscú. 1983.