|
|
| Línea 1: |
Línea 1: |
| − | | + | {{Desarrollo}} |
| | {{Definición | | {{Definición |
| | |nombre= La gluconeogénesis | | |nombre= La gluconeogénesis |
| Línea 14: |
Línea 14: |
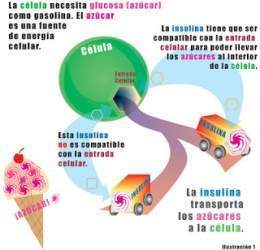
| | El músculo obtiene ATP a partir de la glucolisis. Cuando las condiciones del ejercicio son anaeróbicas la glucosa se degrada a lactato. El lactato es exportado a la circulación y es captado por el hígado. El hígado sintetiza glucosa de nuevo a partir de lactato por la ruta gluconeogénica. | | El músculo obtiene ATP a partir de la glucolisis. Cuando las condiciones del ejercicio son anaeróbicas la glucosa se degrada a lactato. El lactato es exportado a la circulación y es captado por el hígado. El hígado sintetiza glucosa de nuevo a partir de lactato por la ruta gluconeogénica. |
| | Estas dos vías metabólicas que permiten el acoplamiento de la función de dos tejidos es lo que se conoce como el ciclo de Cori. | | Estas dos vías metabólicas que permiten el acoplamiento de la función de dos tejidos es lo que se conoce como el ciclo de Cori. |
| − |
| |
| − | ===Las reacciones de rodeo===
| |
| − | *De piruvato afosfoenol piruvato
| |
| − | *De fructosa 1,6 bifosfato afructosa 6-fosfato
| |
| − | *De glucosa-6-fosfato aglucosa
| |
| − | ==Entrada a la ruta==
| |
| − | El lactato regresa al hígado donde es convertido en piruvato mediante la enzima lactato deshidrogenasa. Una vez que se genera el piruvato este puede funcionar como sustrato para la formación de glucosa.Los aminoácidos pueden entrar ya sea mediante transaminación o desaminación, o bien, mediante la incorporación al ciclo de los ácidos tricarboxílicos. La ruta puede llevarse a cabo tanto en la [[mitocondria]] como en el [[citoplasma]], según donde se encuentren los sustratos.
| |
| − | ==Las reacciones de la gluconeogénesis==
| |
| − | *Primera reacción de rodeo. La ruta comienza con el piruvato o el oxalacetato a través de la carboxilación del piruvato.
| |
| − | La reacción requiere de ATP y requiere de dos reacciones exergónicas.
| |
| − | #Es catalizada por la piruvato carboxilasa y la PEP-carboxiquinasa.
| |
| − | #La enzima se activa por altos niveles de acetil-CoAproducidos durante la ß-oxidación e inhibida por altos niveles de ADP.
| |
| − | #Se lleva a cabo entre la mitocondria y el citosol.
| |
| − | ==Rutas desde el piruvato hasta el PEP==
| |
| − | La conversión de al anina a piruvato ocurre dentro de la mitocondria por transaminación, donde se elimina el grupo α-amino y se adiciona a un α-cetoácido carboxílico. Una piruvato carboxilasa convierte el piruvato en oxalacetatoacoplada a coenzima biotina, que funciona como un transportador de HCO3-Piruvato + HCO3-Oxalacetato + ADP + Pi
| |
| − | Mecanismo de la piruvato carboxilasa Activación del CO2Unión del CO2 activado a la biotina.Paso del CO2 desde biotina al piruvato. El brazo unidoa biotinapermite el transporte del CO2 entre los doscentros activos del enzima.La etapa de carboxilación de la biotina de la unión
| |
| − | La piruvato carboxilasaes la primer enzimaregulador en la ruta de lagluconeogénesis; elacetil-CoA es un efectorpositivo necesario para laenzima.La reacción de lapiruvato carboxilasapuede reponerintermediarios de otraruta metabólica central,el ciclo del ácido cítrico.
| |
| − | La carencia de un transportador en la membranamitocondrial para el oxalacetato se compensa con lapresencia de una malato deshidrogenasa que, a expensasde NADH + H+, produce L-malato del oxalacetato.La variación de energía libre estándar de esta reacción esmuy elevada pero, en condiciones fisiológicas, ΔG~0, por loque la reacción es fácilmente reversible.La malato deshidrogenasa funciona tanto para lagluconeogénesis como para el CAT aunque ocurran endirecciones antagónicas.Oxalacetato + NADH + H+L-Malato + NAD+El malato abandona la mitocondria dada la presencia de untransportador específico. En el citosol otra malatodeshidrogenasa revierte la reacción produciendo NADHcitosólico.L-Malato + NAD+Oxalacetato + NADH + H+
| |
| − | Finalmente, el oxalacetato es convertido afosfoenolpiruvato por una PEP carboxiquinasa. Estaenzima está presente tanto en la mitocondria comoen el citosol. La reacción es dependiente de Mg+2yutiliza GTP como donador de un fosforilo.La reacción es reversible en condicionesintracelulares; la formación de un compuestofosfato de alta energía (PEP) se compensa con lahidrólisis de otro (GTP).Oxalacetato + GTP PEP + CO2 + GDPPiruvato + ATP + GTP + HCO3-PEP + ADP + GDP + Pi + CO2ΔG´0= 0.9 kJ/mol
| |
| − | Segunda reacción de rodeo. La conversión defructosa 1,6 bifosfato en fructosa 6-fosfato estácatalizada por la enzima fructosa 1,6-bisfosfatasa(FBPasa-1), dependiente de Mg2+que promueve lahidrólisis prácticamente irreversible del fosfato enC-1 (no transferencia de grupo fosforilo al ADP).Fructosa 1,6-bifosfato + H2O Fructosa 6-fosfato+6PiΔG´0= - 16.3 kJ/mol
| |
| − | Tercera reacción de rodeo. La conversión deglucosa 6-fosfato en glucosa está catalizada poruna glucosa 6-fosfatasa. Esta síntesis no produceATP sino que genera la hidrólisis de un éster fosfato.Glucosa 6-fosfato + H2O Glucosa + PiΔG´0= - 13.8 kJ/molEsta reacción se lleva a cabo en el lumen delretículo endoplásmico, donde al producirse esliberada al citosol mediante transportadores deglucosa. La glucosa 6-fosfatasa no se encuentra entejidos cerebrales ni musculares, solamente enhepáticos y renales.
| |
| − | La glucosa-6-fosfato estransportada al lumen delretículo endoplásmico poruna glucosa-6-fosfatasaunida a la membrana.Dentro del RE se acumulanglucosa y ácido fosfórico.Asociadas a la glucosa 6-fosfato se encuentran una proteínaestabilizadora dependiente de Ca+2(SP), y tres transportadores: uno queintroduce la glucosa 6-fosfato (T1) y dos que expulsan los productos, alfosfato inorgánico (T2) y a la glucosa (T3), hacia el citosol.
| |
| − | Costo de la GluconeogénesisLa glucogenogénesis es muy cara energéticamen-te pero sumamente esencial.2Piruvato + 4ATP + 2GTP + 2NADH + 2H++ 4H2OGlucosa + 4ADP + 2GDP + 6Pi + 2NAD+Tanto la gluconeogénesis como la glucólisis sonprocesos celulares irreversibles.Algunos, o todos, los átomos de carbono de lamayoría de los aminoácidos procedentes de lasproteínas se convierten en último término enpiruvato o en intermediarios del ciclo del ácidocítrico.
| |
| − | Tales aminoácidos pueden, por tanto, experimentaruna conversión neta en glucosa, por lo que sedenominan aminoácidos glucogénicos.La alanina y la glutamina, principales moléculastransportadoras de grupos amino desde los tejidosextrahepáticos al hígado, son aminoácidosglucogénicos muy importantes en los mamíferos.Después de eliminar sus grupos amino en lasmitocondrias hepáticas, los esqueletos carbonadosrestantes (piruvato y α-cetoglutarato,respectivamente) se canalizan rápidamente haciala gluconeogénesis.
| |
| − | Los animales no pueden convertir acetil-CoAobtenido de la oxidación de ácidos grasos englucosa; las plantas y los microorganismos sípueden.Las plantas, levaduras y muchas bacterias tienenuna ruta (el ciclo del glioxilato) para convertir elacetil-CoA en oxalacetato, por lo que estosorganismos pueden utilizar ácidos grasos comomaterial de partida para la gluconeogénesis.Esto es de importancia especial durante lagerminación de las semillas, antes de que lafotosíntesis pueda servir como fuente de glucosa.
| |
| − | Regulación coordinada de lagluconeogénesis y la glucólisisLas reacciones catalizadas por la PFK-1 y FBPasa-1están reguladas alostéricamente y pormodificación covalente (fosforilación).La glucólisis y la gluconeogénesis están reguladasrecíprocamente para impedir que se produzca elfuncionamiento despilfarrador de ambas rutas almismo tiempo: cuando aumenta el flujo de glucosaa través de la glucólisis, el flujo de piruvato haciaglucosa disminuye y viceversa.
| |
| − | Existen diversos puntoscontrol en esta rutaEn la ruta que conduce delpiruvato a la glucosa el primerpunto de control determina eldestino del piruvato en lamitocondria. El piruvato sepuede convertir en acetil-CoA(por el complejo piruvatodeshidrogenasa) para elimpulsar el ciclo del ácidocítrico, o en oxalacetato (porla piruvato carboxilasa) parainiciar el proceso de lagluconeogénesis.•La gluconeogénesis estáregulada a nivel de piruvato.
| |
| − | La gluconeogénesis está regulada anivel de la FBPasa-1 (que es inhibidapor la fructosa 2,6-bisfosfato y por elAMP).El correspondiente enzimaglucolítico, PFK-1, es estimulado porel AMP y el ADP pero es inhibido porel citrato y el ATP, por lo que estosdos pasos opuestos en las dos víasestán regulados de formacoordinada y recíproca.En general, cuando se encuentrapresente suficiente concentración deacetil-CoA o citrato (el producto dela condensación del acetil-CoA conel oxalacetato) o cuando sefavorece una elevada proporción deladenilato celular en forma de ATP, lagluconeogenésis está favorecida.El AMP promueve la degradación delglucógeno y la glucólisis al activar laglucógeno fosforilasa (vía activaciónde la fosforilasa quinasa) y estimularla actividad de la PFK-1.
| |
| − | La fructosa 2,6-bisfosfato es un regulador potentede la glucólisis y de la gluconeogénesis.Para limitar el ciclado inútil entre la glucólisis y lagluconeogénesis, las dos rutas están bajo controlalostérico recíproco, el cual se consiguemayoritariamente por los efectos opuestos de lafructosa 2,6-bisfosfato sobre la PFK-1 y la FBPasa-1.Cuando descienden los niveles sanguíneos deglucosa la hormona glucagón indica al hígado queproduzca y libere más glucosa y que deje deconsumirla para sus propias necesidades.Una fuente de glucosa es el glucógenoalmacenado en el hígado, otra fuente es lagluconeogénesis.
| |
| − | La regulación hormonal de la glucólisis y de lagluconeogénesis en el hígado está mediada por lafructosa 2,6-bisfosfato, un efector alostérico de losenizmas PFK-1 y FBPasa-1.Cuando se fija la furctosa 2,6-bisfosfato a su sitioalostérico sobre la PFK-1, aumenta la afinidad deeste enzima por su sustrato fructosa 6-fosfato yreduce su afinidad por los inhibidores alostéricosATP y citrato.
| |
| − | La fructosa 2,6-bisfosfato activa la PFK-1, con lo queestimula la glucólisis hepática y al mismo tiempoinhibe la FBPasa-1, reduciendo de este modo lagluconeogénesis.La fructosa 2,6-bisfosfato es un regulador cuyo nivelcelular refleja el nivel de glucagón en la sangre, elcual aumenta cuando disminuye el nivel deglucosa sanguínea.La concentración celular de fructosa 2,6-bisfosfatoviene dictada por las velocidades relativas deformación y degradación.
| |
| − | El equilibrio de estas dos actividades en el hígado y, porconsiguiente, el nivel celular de fructosa 2,6-bisfosfato, estánregulados por el glucagón y la insulina. El glucagón estimula ala adenilato ciclasa del hígado para que sintetice AMP cíclicoa partir de ATP.A su vez, el AMP cíclico activa una proteína quinasadependiente de AMPc, que transfiere un grupo fosfato desdeel ATP al enzima bifuncional PFK-2/FBPasa-2.La fosforilación de esta proteína potencia su actividad FBPasa-2 e inhibe la actividad de la PFK-2. De este modo, el glucagóndisminuye el nivel celular de fructosa 2,6-bisfosfato inhibiendola glucólisis y estimulando la gluconeogénesis.La resultante producción de más glucosa permite que elhígado reponga los niveles de glucosa sanguínea enrespuesta al glucagón.
| |
| − | La insulina tiene el efecto opuesto, ya que estimula laactividad de una fosfoproteína fosfatasa que cataliza laeliminación del grupo fosforilo de la proteína de dos funcionesPFK-2/FBPasa-2, aumentando su actividad PFK-2, lo queincrementa la concentración de fructosa 2,6-bisfosfato, con loque se estimula la glucólisis y se inhibe la gluconeogénesis.
| |
| − |
| |
| − |
| |
| | | | |
| | == Fuentes == | | == Fuentes == |