Diferencia entre revisiones de «Hidróxido de hierro III»
(Página creada con ' {{Elemento_químico |nombre= Hidróxido de hierro (III) |imagen= hidroxido_ferroso.jpg |nombre,simbolo,numero= Hidróxido de hierro (III) Fe(OH)<sub>3</sub> |serie_quimica= Hid...') |
m (Texto reemplazado: «<div align="justify">» por «») |
||
| (No se muestran 13 ediciones intermedias de 2 usuarios) | |||
| Línea 1: | Línea 1: | ||
| − | |||
{{Elemento_químico | {{Elemento_químico | ||
|nombre= Hidróxido de hierro (III) | |nombre= Hidróxido de hierro (III) | ||
| − | |imagen= | + | |imagen= hidroxido_ferrico.jpg |
| − | |nombre,simbolo,numero= Hidróxido de hierro (III) Fe(OH)<sub>3</sub> | + | |nombre,simbolo,numero= Hidróxido de hierro (III), Fe(OH)<sub>3</sub> |
| − | |serie_quimica= | + | |serie_quimica= Se le denomina hidróxido férico |
}} | }} | ||
| − | + | ||
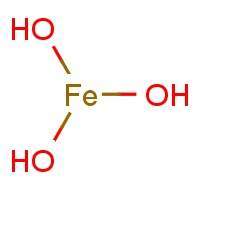
| − | '''El hidróxido de hierro (III)''', Fe(OH)<sub>3</sub>, es un | + | '''El hidróxido de hierro (III)''', Fe(OH)<sub>3</sub>, es un compuesto químico que aparece como precipitado tras alcalinizar disoluciones que contienen sales de [[hierro]], es un [[Coloides|coloide]] gelatinoso de difícil filtración. |
| + | |||
| + | == Estado Natural == | ||
| + | === Propiedades === | ||
| + | ==== Propiedades Físico químico ==== | ||
| + | |||
| + | * Es de color blanquecino y precisa mayor alcalinización, por encima de 7. | ||
| + | * Peso molecular: 106.867 | ||
| + | * Densidad 3.4 ~ 3.9 g/cm<sup>3</sup>. | ||
| + | * Soluble en ácidos inorgánicos y orgánicos. | ||
| + | * Soluble en álcali concentrado caliente. | ||
| + | * Insoluble en agua, etanol y éter | ||
| − | == | + | === Estabilidad y reactividad === |
| − | + | *Productos de descomposición térmica | |
| − | = | + | 2Fe(OH)<sub>3</sub> == == △ Fe<sub>2</sub>O<sub>3</sub> + 3H<sub>2</sub>O |
| − | * | + | * Reacción de ácido no oxidante: |
| + | |||
| + | Fe(OH)<sub>3</sub> + 3H (iones de hidrógeno) = Fe<sub>3</sub> (ión férrico) + 3H<sub>2</sub>O | ||
| + | |||
| + | === Obtención === | ||
| − | + | * Hidróxido ferroso reacciona con el oxígeno: | |
| − | = | + | 4Fe(OH) <sub>2</sub> + O<sub>2</sub> + 2H<sub>2</sub>O = 4Fe(OH)<sub>3</sub> |
| − | == Usos y almacenamiento== | + | == Usos y almacenamiento == |
| + | * Se utiliza para la fabricación de pinturas. | ||
| + | * Elaboración de medicamentos. | ||
| + | * También pueden ser utilizados para antídoto del arsénico. | ||
| − | == | + | == Enlace Externo == |
| − | + | * [http://www.alonsoformula.com/.../hidroxidos.htm Hidróxidos metálicos alonsoformula.com]. | |
| − | == | + | == Fuente == |
| − | * | + | * Adolfo Ponjuan y Blanco. Química Inorgánica Tomo I. [[Editorial Pueblo y Educación]], 1979. |
[[Category:Química]] | [[Category:Química]] | ||
última versión al 22:43 13 ago 2019
| ||||||||||
El hidróxido de hierro (III), Fe(OH)3, es un compuesto químico que aparece como precipitado tras alcalinizar disoluciones que contienen sales de hierro, es un coloide gelatinoso de difícil filtración.
Sumario
Estado Natural
Propiedades
Propiedades Físico químico
- Es de color blanquecino y precisa mayor alcalinización, por encima de 7.
- Peso molecular: 106.867
- Densidad 3.4 ~ 3.9 g/cm3.
- Soluble en ácidos inorgánicos y orgánicos.
- Soluble en álcali concentrado caliente.
- Insoluble en agua, etanol y éter
Estabilidad y reactividad
- Productos de descomposición térmica
2Fe(OH)3 == == △ Fe2O3 + 3H2O
- Reacción de ácido no oxidante:
Fe(OH)3 + 3H (iones de hidrógeno) = Fe3 (ión férrico) + 3H2O
Obtención
- Hidróxido ferroso reacciona con el oxígeno:
4Fe(OH) 2 + O2 + 2H2O = 4Fe(OH)3
Usos y almacenamiento
- Se utiliza para la fabricación de pinturas.
- Elaboración de medicamentos.
- También pueden ser utilizados para antídoto del arsénico.
Enlace Externo
Fuente
- Adolfo Ponjuan y Blanco. Química Inorgánica Tomo I. Editorial Pueblo y Educación, 1979.