Diferencia entre revisiones de «Hidróxido de hierro III»
(→Usos y almacenamiento) |
(→Propiedades Físico químico) |
||
| Línea 16: | Línea 16: | ||
* Es de color blanquecino y precisa mayor alcalinización, por encima de 7. | * Es de color blanquecino y precisa mayor alcalinización, por encima de 7. | ||
| − | * Peso molecular: 106.867 | + | * Peso molecular: 106.867 |
| − | * Densidad 3.4 ~ 3. | + | * Densidad 3.4 ~ 3.9 g/cm<sup>3</sup>. |
* Soluble en ácidos inorgánicos y orgánicos. | * Soluble en ácidos inorgánicos y orgánicos. | ||
* Soluble en álcali concentrado caliente. | * Soluble en álcali concentrado caliente. | ||
* Insoluble en agua, etanol y éter | * Insoluble en agua, etanol y éter | ||
| − | |||
===Estabilidad y reactividad=== | ===Estabilidad y reactividad=== | ||
Revisión del 12:26 18 jun 2014
| ||||||||||
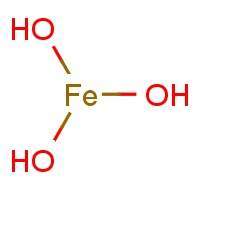
El hidróxido de hierro (III), Fe(OH)3, es un compuesto químico que aparecen como precipitado tras alcalinizar disoluciones que contienen sales de hierro, es un coloide gelatinoso de difícil filtración.}}
Sumario
Estado Natural
Propiedades
Propiedades Físico químico
- Es de color blanquecino y precisa mayor alcalinización, por encima de 7.
- Peso molecular: 106.867
- Densidad 3.4 ~ 3.9 g/cm3.
- Soluble en ácidos inorgánicos y orgánicos.
- Soluble en álcali concentrado caliente.
- Insoluble en agua, etanol y éter
Estabilidad y reactividad
- Productos de descomposición térmica
2Fe(OH)3 == == △ Fe2O3 + 3H2O
- Reacción de ácido no oxidante:
Fe(OH)3 + 3H (iones de hidrógeno) = Fe3 (ión férrico) + 3H2O
Obtención
- Hidróxido ferroso reacciona con el oxígeno:
4Fe(OH) 2 + O2 + 2H2O = 4Fe(OH)3
Usos y almacenamiento
- Se utiliza para la fabricación de pinturas
- Elaboración de medicamentos.
- También pueden ser utilizados para antídoto del arsénico.
Fuente
Adolfo Ponjuan y Blanco Química Inorgánica Tomo I