Autofagia
| ||||||
Autofagia o autodigestión celular es una ruta implicada en la degradación de proteínas y orgánulos que puede ser importante en la patogenia de algunas enfermedades. Paradójicamente aunque la autofagia es en principio un proceso protector de la célula puede también jugar un papel en la muerte celular. El conocimiento profundo de este proceso puede abrir nuevas líneas de investigación hacia la mejora de la salud humana. El término «autofagia» fue acuñado por el bioquímico belga Christian de Duve en 1963. La investigación contemporánea arrancó en la década de 1990 con la identificación en levaduras de los genes relacionados con este proceso. Uno de los investigadores, Yoshinori Ohsumi, recibió el Nobel de Medicina en 2016 por sus trabajos.
Sumario
Descripción
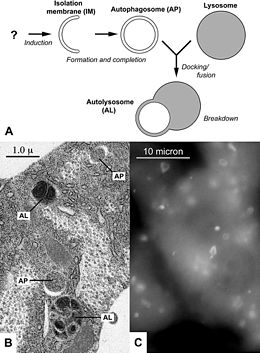
Es un proceso celular que se encarga de la degradación y reciclaje de componentes celulares. Durante la autofagia, porciones del citosol, incluyendo orgánulos completos, son englobadas en una doble membrana que se cierra para formar un autofagosoma o vacuola de autofagia, que se fusionará permitien la digestión de los componentes englobados. La autofagia tiene un papel esencial en la obtención de nutrientes en condiciones de ayuno, en la degradación de orgánulos dañados, por lo que supone un mecanismo que permite a las células sobrevivir en condiciones de estrés.
Sin embargo también y se ha sugerido que es un modo alternativo de muerte celular programada que se ha observado tanto durante el desarrollo así como durante las enfermedades neurodegenerativas.
A primera vista no parece lógico que un proceso de autodigestión pueda ser beneficioso pero en casos de falta de nutrientes la célula se ve obligada a utilizar sus propios recursos para sobrevivir. Así, por ejemplo, en la vida diaria en los períodos de ayuno entre las comidas la autofagia se activa en el hígado para mantener sus funciones metabólicas.
Tipos
Existen varios tipos de autofagia entre los que se encuentran la macroautofagia, la microautofagia y la autofagia mediada por chaperonas (CMA: Chaperone Mediated Autofagia). En la microautofagia se fagocitan grandes estructuras celulares a través de mecanismos selectivos mientras que en la macroautofagia se fagocitan de forma no selectiva. La autofagia mediada por chaperonas es responsable de la degradación selectiva únicamente de proteínas solubles. Resulta vital que exista una fina regulación de los procesos de autofagia dentro de la célula.
La identificación de genes relacionados con la autofagia y la aparición de nuevos métodos de monitorización de los procesos de autofagia permitirá avanzar en el conocimiento de este importante proceso celular.
Autofagia en la supervivencia y la muerte celular
La autofagia aumenta la supervivencia celular en estados de deprivación de nutrientes o de factores de crecimiento, de stress del retículo endoplásmico, de desarrollo, de infección microbiana y de enfermedad por acumulación de agregados de proteínas. En general esta función es beneficiosa, pero en algunos estados tumorales es potencialmente perjudicial. El stress metabólico es común en el microambiente tumoral y la mayoría de los agentes quimioterápicos inducen stress celular, lo cual aumentaría la autofagia y, como consecuencia, podría aumentar la supervivencia celular. Esto justifica la intensa investigación que se está desarrollando en esta área ya que podría ser crucial bloquear la autofagia para conseguir una eliminación total de las células tumorales.
No es fácil discernir hasta qué punto la autofagia resulta en un balance positivo o negativo de la supervivencia celular. Experimentos bloqueando genes asociados con la autofagia parecen acelerar la muerte celular pero, sin embargo, existen excepciones como la activación descontrolada de la proteína Beclin 1, involucrada en la autofagia, que produce un aumento de la muerte celular. Esto puede deberse a una activación de la apoptosis o a una degradación masiva de contenido citoplásmico. Las interrelaciones entre la autofagia, que funciona primariamente como mecanismo de supervivencia celular y la apoptosis, que es una ruta que conduce inevitablemente a la muerte celular, son complejas. Los dos mecanismos son regulados por factores comunes, comparten componentes y se influyen uno a otro. Muchas señales de activación de apoptosis inducen también autofagia y existen señales que inhiben ambos procesos. Hasta ahora los intrincados mecanismos moleculares entre ambos están aún por completar.
Neurodegeneración
Cada vez aparecen más evidencias que demuestran que existen alteraciones en los procesos de autofagia en muchas enfermedades neurodegenerativas.
Enfermedades en cuya patogenia ya se ha demostrado una relación con la autofagia
La autofagia ocurre a nivel basal y es clave para llevar a cabo el “control de calidad” intracelular. La demanda de autofagia basal depende del tipo de tejido. Es especialmente necesaria en tejidos en los que las células no se dividen tras la diferenciación como es el caso de células hepáticas, neuronas o miocitos. Los requerimientos de autofagia son aún mayores en los estados de enfermedad. Estudios recientes demuestran que la degradación de proteínas mutadas que se generan en muchas enfermedades neurodegenerativas es muy dependiente de la autofagia. Entre ellas las proteínas conteniendo secuencias de poliglutamina causantes de enfermedades como el Huntington o la ataxia espinocerebelosa y las formas de alfa-sinnucleina que causan el Parkinson familiar. La autofagia mediada por chaperonas también participa en la degradación de la alfa-sinnucleína pero las formas mutadas bloquean el receptor lisosomal inhibiendo este tipo de autofagia. Esto resulta en un aumento compensador de la macroautofagia que hace que las células sean más sensibles al estrés.
Los experimentos disponibles demuestran que la autofagia es beneficiosa en la prevención de la neurodegeneración pero aún hay puntos por aclarar en los mecanismos de esta prevención. Una hipótesis propone que la autofagia elimina agregados de proteínas y cuerpos de inclusión de una manera directa. Un posible mediador de esto podría ser p62/sequestosoma-1.
En la enfermedad de Alzheimer se han observado alteraciones en los procesos de autofagia. Una hipótesis propone que existe un flujo alterado en el proceso autofágico. En las neuritas distróficas que aparecen en el Alzheimer parece producirse una acumulación de estructuras de tipo autofagosomas que no acaban de madurar hacia autolisosomas, porque no se unen a lisosomas. Además el amilode beta (Abeta) puede producirse en estas estructuras ya que contienen las proteasas necesarias para su producción en los restos de retículo endoplásmico secuestrado que contienen.
Es razonable pensar que la autofagia es una prometedora diana terapéutica para algunas enfermedades neurodegenerativas. Así, se ha demostrado en modelos en Drosophila y ratón que la estimulación de la autofagia mediante inhibidores de la proteína TOR protege de la neurodegeneración que se produce en los modelos de enfermedades por poliglutaminas.
Inmunidad innata y adaptativa
La eliminación de organismos intracelulares similares a organelas celulares es un reto para las rutas degradativas que sólo puede afrontar la autofagia. La misma maquinaria de la autofagia se utiliza también para la degradación de microorganismos intracelulares denominándose este proceso xenofagia. Recientes estudios parecen indicar que la autofagia es también muy importante para suministrar material antigénico de patógenos al sistema inmune innato y adaptativo.
La diana de la xenofagia pueden ser bacterias extracelulares que invaden el espacio intracelular, bacterias y parásitos citosólicos, fagosomas, vacuolas que contengan patógenos o viriones recién sintetizados que invadan el citoplasma celular. La xenofagia está aún menos estudiada que la autofagia clásica y así, por ejemplo, no se sabe aún si las membranas que engloban a los microorganismos tienen una biogénesis similar o diferente a la de los autofagosomas, o qué mecanismos gobiernan el reconocimiento de los microbios por la maquinaria autofágica.
La autofagia se requiere para que los ácidos nucléicos alcancen los receptores endosómicos TLR-7 y para que ciertos antígenos virales sean presentados por clase II. La interrelación entre sistema inmune y autofagia es bidireccional ya que también mediadores tanto de la inmunidad innata como de la adaptativa estimulan la autofagia. Algunos patógenos han desarrollado distintas estrategias para escapar de la autofagia. Algunos modulan las rutas de señalización que regulan la autofagia o bloquean el tráfico vesicular que lleva a la fusión con lisosomas. Un ejemplo de la importancia de la autofagia en la defensa antiviral es la necesidad de que se produzca un bloqueo de la proteína beclina 1, clave en la autofagia, por parte de una proteína producida por el virus del herpes para que se produzca la encefalitis por herpes simple.
La autofagia también parece ser importante en el mantenimiento de la homeostasis de las células T, que es central en el establecimiento de la tolerancia periférica y en la prevención de la autoinmunidad. Estudios de asociación realizados a escala de genoma han demostrado que existe una asociación de los genes ATG16L1 y GTPase IRGM con la enfermedad de Crohn, lo que indica la importancia de la autofagia en el establecimiento de enfermedades autoinmunes.
Cáncer
El cáncer es una de las primeras enfermedades que se relacionó con la autofagia. En el 40-75% de los casos de cáncer de mama, de cáncer de ovario y de cáncer de próstata se observa la pérdida de uno de los alelos del gen del inhibidor tumoral beclina 1. Ratones con un bloqueo heterocigótico de la beclina 1 tienen la autofagia disminuida y tienen mayor tendencia a padecer linfomas, carcinomas de pulmón, carcinomas hepatocelulares y lesiones mamarias precancerosas. Otros genes que refuerzan la actividad del complejo beclina1/PI3K (phosphatidylinositol 3-kinase) como el gen UVRAG (UltraViolet Resistance-Associated Gene), el gen Ambral y el gen Bif-1 también parecen jugar un papel en la supresión de tumores. Otros genes que participan en la autofagia (en general denominados genes ATG) como el gene ATG4c también ejercen efecto supresor de tumores. Esto lleva a pensar que, en conjunto, todas las proteínas que estimulan la autofagia pueden tener propiedades de inhibición tumoral. Además, existen evidencias crecientes sobre la interrelación entre las rutas de señalización oncogénica y las de la autofagia. Así oncogenes como class I PI3K, PKB, TOR o Bcl-2 inhiben la autofagia mientras que genes supresores de tumores como p53, PTEN, DAPk o TSC1/TSC2 estimulan la autofagia. Todo esto sugiere que la autofagia es una verdadera ruta supresora de tumores. Además estudios recientes parecen indicar que los genes de la beclina 1 y el gen atg5 funcionan como guardianes de la integridad del genoma. Así se ha visto que células inmortalizadas con pérdida de uno o ambos alelos de estos genes muestran daño en el ADN, amplificación de genes y aneuploidia, especialmente si existe isquemia, además de elevada tumorigenicidad.
Aunque en la autofagia el efecto de aumentar la supervivencia celular suele estar contrapesado por su efecto supresor de tumores existe debate sobre si la autofagia puede ser un proceso negativo en el tratamiento del cáncer con quimioterapia. Existen ensayos clínicos en marcha en los que se bloquean procesos degradativos de autofagia durante la quimioterapia. Es muy importante intervenir sobre la autofagia de una forma específica adaptada al contexto y a la fase de la enfermedad. Así, por ejemplo, aumentar la autofagia puede ser beneficioso en la prevención de la formación del tumor y evitar su progresión mientras que inhibir la autofagia puede ser ventajoso para promover su regresión completa.
Envejecimiento y longevidad
Una característica común del envejecimiento celular es la acumulación de proteínas y orgánulos dañados. Estos depósitos alterados son especialmente negativos en las células diferenciadas que ya no se dividen como las neuronas o los miocardiocitos. La macroautofagia y la autofagia mediada por chaperonas (CMA) también disminuyen con la edad. Esto indica que la autofagia es un proceso clave en el envejecimiento. Apoyando esta importancia existen modelos de ratón con la autofagia alterada en los que el fenotipo de envejecimiento es dramático. En la misma dirección existen experimentos en los que la restricción calórica reduce el envejecimiento probablemente debido a los bajos niveles de insulina que tienen una acción inhibidora de la autofagia. Este estado de deprivación de nutrientes estimulador de la autofagia es también el objetivo de algunos nuevos tratamientos anti-envejecimiento basados en fármacos anti-lipolíticos.