Leucemia linfoide crónica
| ||||
Leucemia Linfoide Crónica (LLC) es el tipo de leucemia más frecuente en los individuos caucásicos. Su incidencia tiene una gran variación de acuerdo con el área geográfica.
Sumario
La leucemia linfoide crónica
Es un síndrome linfoproliferativo crónico que se caracteriza por la acumulación de linfocitos en sangre periférica, médula ósea, ganglios linfáticos, bazo y otros tejido.
Diagnóstico
El diagnóstico de LLC depende fundamentalmente de la comprobación de linfocitosis en Sangre periférica y Médula ósea.
Se puede diagnosticar LLC cuando hay un aumento del número absoluto de linfocitos en sangre periférica, con características citomorfológicas e inmunofenotípicas que apoyan ese diagnóstico. El estudio molecular complementa estas investigaciones y permite confirmar la naturaleza clonal de la enfermedad.
Se ha señalado que ante la presencia de estos criterios no es necesario el examen de la médula ósea. Sin embargo, suele hacerse rutinariamente, ya que resulta útil para valorar el pronóstico de la enfermedad y la respuesta al tratamiento.
En algunas ocasiones, es necesario diferenciar la LLC de otros procesos linfoproliferativos crónicos con expresión leucémica. Entre estos tenemos la leucemia prolinfocítica, la leucemia de Células peludas, el linfoma esplénico con linfocitos vellosos, el linfoma folicular, el linfoma del manto y el linfoma linfoplasmocitoide. El examen cuidadoso de la morfología de los linfocitos circulantes asociado con la evaluación del inmunofenotipo celular, son los 2 elementos básicos para establecer el diagnóstico diferencial. Sin embargo, en algunos casos, es necesario acudir a los estudios histopatológicos, la citogenética y la biología molecular.
Estado de la enfermedad
1. A partir del concepto de que las manifestaciones de la LLC se relacionan con la acumulación progresiva de linfocitos, se han propuesto diferentes sistemas de estadificación que reflejan lo más directamente posible la magnitud de la masa tumoral y permiten evaluar los estados menos y más avanzados de la enfermedad. Los 2 esquemas más ampliamente utilizados son el de Rai y el de Binet.
El sistema de Rai se fundamenta en la linfocitosis presente en sangre periférica y en médula ósea, la existencia de organomegalias (adenopatías, hepatomegalia, esplenomegalia) y de citopenias (Anemia, Trombocitopenia). El sistema de Binet se basa en el número de áreas afectadas (ganglionares, hepática, esplénica) y en la presencia de citopenias (anemia, trombocitopenia). En total se consideran solo 5 áreas, pues de las 3 ganglionares (cervical, axilar e inguinal), cada una se evalúa como un solo grupo, independientemente que esté afectada unilateral o bilateralmente. En ambos sistemas los estados más avanzados están definidos por la presencia de citopenias. La mayor ventaja que se le atribuye a estos sistemas de estadificación es su valor en el pronóstico de la evolución de la enfermedad.
2. Enfermedad indolente, larvada o quiescente (smouldering).
En los últimos años se ha establecido el importante concepto de LLC indolente, también llamada larvada o quiescente. Este concepto surgió de la observación de que mientras en los estadios menos avanzados de la enfermedad hay pacientes que muestran progresión evolutiva, otros se mantienen en ese estado con una incidencia muy baja de progresión y con una supervivencia similar a la de una población control de igual sexo y edad. Montserrat y colaboradores, definieron la LLC indolente como un subgrupo de LLC en estadio A, con patrón histológico de infiltración no difusa de la Médula ósea, Hemoglobina ³ 13g/dL, linfocitos en Sangre periférica <30 x 109 /L y un tiempo de duplicación linfocitaria >12 meses.
Otros autores han incluido en este criterio a los enfermos en estadio 0 de Rai, que cumplan los parámetros hematológicos y cinéticos establecidos por Montserrat y colaboradores.
Por otra parte, el grupo cooperativo francés ofreció criterios ligeramente diferentes y constituyó 2 subestadios A: el A1 con linfocitos <30 x 109 /L y hemoglobina >12 g/dL, y el A2 con linfocitos <30 x 109 /L, hemoglobina >12 g/dL, < 80 % de linfocitos en el aspirado medular y menos de 2 áreas afectadas.
3. Enfermedad activa.
La presencia de actividad se considera ante la expresión al menos de uno de los siguientes criterios:
a) Uno o más de los siguientes síntomas:
- Pérdida de peso ³10 % en los 6 meses previos.
- Fatiga extrema.
- Fiebre al menos por 2 semanas sin evidencia de infección.
- Sudoración nocturna sin evidencia de infección
b) Insuficiencia medular progresiva manifestada por establecimiento o acentuación de la anemia, trombocitopenia o ambas.
c) Anemia autoinmune, trombocitopenia autoinmune o ambas, que no responden a los corticosteroides.
d) Esplenomegalia masiva (>6 cm por debajo del reborde costal izquierdo) o progresiva.
e) Ganglios masivos o fusionados (>10 cm en el diámetro mayor) o adenopatías progresivas.
f) Linfocitosis progresiva con un aumento >50 % en un período de 2 meses o un tiempo de duplicación de los linfocitos <6 meses.
4. Enfermedad progresiva.
De acuerdo con los criterios del NCI-WG ste estado se manifiesta cuando se observa al menos una de las siguientes características:
a) Aumento (³50 %) en la suma del tamaño de al menos 2 ganglios linfáticos en 2 determinaciones sucesivas separadas por 2 semanas (al menos uno de los ganglios debe ser ³ 2 cm); o aparición de nuevas adenopatías.
b) b) Aumento (³50 %) del número absoluto de linfocitos circulantes hasta al menos 5 x 109/L.
c) Transformación en un proceso más agresivo como el síndrome de Richter o la leucemia prolinfocítica (>55 % de prolinfocitos).
Para el IW-CLL la progresión sería el paso de la enfermedad a un estadio clínico hematológico más avanzado que el que presentaba previamente.
5. Enfermedad estable: se define cuando no existen criterios de actividad o progresión y se mantiene sin cambios en su estadio clínico hematológico.
6. En relación con el tratamiento, la LLC puede alcanzar los siguientes estados: remisión completa, remisión parcial, enfermedad refractaria, recaída y enfermedad mínima residual.
a) Remisión completa (RC).
La definición de RC ha evolucionado a través de tiempo desde la derivada simplemente de una evaluación clínico-hematológica elemental hasta la que toma en consideración criterios de laboratorio más refinados. Esto hace que los porcentajes de RC no sean comparables cuando no se han utilizado los mismos criterios diagnósticos. Para tratar de hacer comparables los resultados, se emitieron criterios por el NCI - WG y el IW- CLL, aunque tampoco estos fueron similares. En el NCI - WG la definición inicial de RC requería que las siguientes condiciones estuviesen presentes por un período de al menos 2 meses:
Examen físico normal, ausencia de síntomas sistémicos, linfocitos £4 x 109/L, neutrófilos ³1,5 x 109/L, plaquetas >100 x 109/L, hemoglobina >11g/dL (en ausencia de transfusiones), linfocitos en médula ósea <30 % y en la biopsia de médula ósea podía haber persistencia de nódulos linfáticos. A esta última situación se le llamó RC nodular (RCn), para diferenciarla de la RC con una médula ósea normal.
Recientemente se ha señalado que el grado real de la citorreducción, y por lo tanto, la persistencia o no de la enfermedad, se puede investigar más profundamente por procederes avanzados, como son el inmunofenotipaje celular mediante citofluorometría de flujo, la técnica citogenética de hibridación in situ con sondas moleculares fluorescentes (FISH) y otros estudios moleculares, pero que en el momento actual solo se han recomendado en trabajos de investigación. Esto nos permitiría precisar cuándo la remisión ha alcanzado el nivel inmunofenotípico y molecular.
b) Remisión parcial (RP).
La RP, de acuerdo con las recomendaciones revisadas del NCI - WG, comporta la reducción de al menos 50 % de la linfocitosis periféricas y de la organomegalia, así como al menos 50 % de mejoría en uno o más de los siguientes parámetros: neutrófilos, plaquetas y hemoglobina. Estas modificaciones deben mantenerse al menos por 2 meses. A estos criterios se ha sugerido añadir la RPn.
Según el IW - CLL, solo se requiere el retorno de la enfermedad a unos períodos menos avanzados de la estadificación clínica.
Cuando la RC y RP se evalúan por los criterios convencionales, sin tomar en cuanta el estado de enfermedad mínima residual, algunos autores usan el término de respuesta en lugar de remisión.
c) Enfermedad refractaria.
Se plantea cuando no se logra alcanzar al menos la RP o hay progresión durante la fase terapéutica
d) Recaída.
Se evidencia por la progresión después de al menos 6 meses de haberse alcanzado RC o RP.
e) Enfermedad mínima residual.
Hasta el momento su evaluación solo se ha realizado en trabajos de investigación y para ello se usan pruebas citofluorométricas, FISH y análisis moleculares. La positividad de estas pruebas en un paciente en RC indica la existencia de enfermedad mínima residual. Se ha señalado que la desaparición de la población que coexpresa CD5/CD19 ó CD20 (o la reducción <10 % de esta población), la normalización de la relación de cadenas ligeras k/l, y la desaparición del reordenamiento de los genes de las inmunoglobulinas, con retorno a la configuración germinal, haría más preciso el criterio de RC. Los pacientes en RC, pero con enfermedad mínima residual detectada mediante estas pruebas, han tenido un intervalo libre de enfermedad menor que aquellos con las pruebas negativas. La terapéutica óptima en casos con enfermedad mínima residual no está aún definida, por lo que se hace necesario ampliar los estudios en este campo. Indudablemente, estas investigaciones contribuirán en el futuro a una mejor definición de la RC y a tomar decisiones terapéuticas oportunas sobre bases más objetivas.
Cuadro Clínico
La LLC presenta diversas manifestaciones clínicas. Con mucha frecuencia, aproximadamente en la mitad de los casos, el diagnóstico se realiza en un individuo totalmente asintomático que se ha hecho un hemograma de rutina o en alguno que se hizo esta prueba por presentar síntomas de una enfermedad banal. En otras ocasiones, los primeros síntomas consisten en aparición de adenopatías, astenia y mal estado general. A diferencia de lo que sucede en los linfomas, la fiebre, sudoración y pérdida de peso no son habituales. Otras veces son las infecciones repetidas, virales o bacterianas, las que motivan la indicación de un hemograma que pone de manifiesto la enfermedad. Es mucho más raro que la primera manifestación de una LLC sea una anemia hemolítica autoinmune (AHAI).
El examen físico también es variable, pues puede ser negativo como sucede en algunos casos con enfermedad poco avanzada o bien mostrar adenopatías, hepatomegalia y esplenomegalia propias de la infiltración progresiva por los linfocitos leucémicos. En los casos con enfermedad poco avanzada se pueden encontrar pequeñas adenopatías localizadas, particularmente en la región cervical o supraclavicular. Sin embargo, a medida que la enfermedad progresa, las adenopatías se hacen más manifiestas y en ocasiones se presentan numerosas adenopatías simétricas indoloras generalizadas que pueden aumentar de tamaño y unirse en grandes masas, a veces notables en las regiones retroperitoneal y mesentérica. En esta situación, la palpación abdominal evidencia con frecuencia las grandes masas tumorales. Las adenopatías mediastínicas o la infiltración del anillo de Waldeyer son muy raras.
Aproximadamente en el 20-30 % de los casos se palpa una esplenomegalia. En general su tamaño es moderado, pero puede variar desde sólo una punta de bazo, que rebasa el reborde costal izquierdo durante la inspiración profunda, hasta una esplenomegalia masiva que en algunos pacientes llega a ocupar todo el hemiabdomen izquierdo. Aproximadamente en el 50 % de los enfermos se encuentra una hepatomegalia ligera. En los estadios más avanzados puede además producirse la infiltración de órganos no linfoides como la próstata, el hígado, en ocasiones con signos de hipertensión portal, el tubo digestivo, el pulmón, la pleura o el sistema nervioso central y más raramente de otros tejidos. A diferencia del dermotropismo que se observa en los síndromes linfoproliferativos de tipo T, en la LLC de tipo B la infiltración cutánea es rara y cuando se presenta, es más frecuente que sea reactiva que infiltrativa. En raras ocasiones se ha comprobado la coexistencia de LLC y síndrome nefrótico, por glomerulonefritis membranosa, que mejora cuando la enfermedad responde al tratamiento.
Complicaciones
En la LLC pueden presentarse diferentes complicaciones. A medida que la enfermedad avanza aumentan las posibilidades de complicaciones secundarias al aumento de la masa tumoral, y es frecuente la aparición de trombocitopenia y anemia secundarias a insuficiencia medular. Muchos enfermos presentan en algún momento de su evolución un estado de inmunodeficiencia adquirida y con mayor frecuencia infecciones bacterianas (74 %), en gran parte de localización pulmonar o del tracto genitourinario, o infecciones virales (21 %), generalmente producidas por virus de tipo herpes. Estas últimas se han incrementado particularmente en los casos tratados con fludarabina. Con menor frecuencia se detectan infecciones micóticas; entre ellas se han comunicado meningitis criptocócica e histoplasmosis
diseminada. Recientemente se ha planteado la posibilidad de instalación de micosis sistémicas, sobre todo producidas por Candida o Aspergilus. Se ha señalado que las infecciones constituyen la principal causa de mortalidad y de morbilidad en la LLC, pues llegan a producirse aproximadamente en el 80 % de los pacientes. La mortalidad de causa infecciosa, según diferentes estudios, está comprendida entre el 30 y el 50 %.Ese estado de inmunodeficiencia predispone a la aparición de segundas neoplasias. Cuando un paciente con LLC presente nuevos síntomas o toma del estado general, sin que para ello exista una explicación adecuada, debe pensarse en la posibilidad de una neoplasia asociada.
Las segundas neoplasias generalmente son carcinomas cutáneos, del tubo digestivo o del pulmón. También se han comunicado casos de LLC asociados a algunas hemopatías mieloides, entre ellas leucemia mieloide crónica, policitemia vera, trombocitemia esencial y leucemia mieloblástica, y síndromes mielodisplásicos, pero sin que se haya establecido una relación causal entre los procesos.
Entre el 10 y el 30 % aproximadamente de las LLC se produce una transformación en un proceso linfoproliferativo más agresivo. La forma más frecuente de transformación es la prolinfocitoide, que tiene una incidencia del 15 al 30 %. En esta situación, la transformación se va expresando por un aumento gradual de los prolinfocitos en la LLC o en su forma mixta prolinfocítica (LLC/LPL), y desde el punto de vista clínico se asocia generalmente con un aumento de las adenopatías, esplenomegalia progresiva, anemia y trombocitopenia. Estas células que morfológicamente son prolinfocitos, generalmente mantienen las características inmunofenotípicas de la LLC, por lo que se consideran prolinfocitos con características intermedias, motivo por el cual con frecuencia se usa el término de «prolinfocitoides» para su denominación.
Con mucha menor frecuencia, el aumento de los prolinfocitos se produce bruscamente; en esta situación a diferencia de la anterior, es usual que los prolinfocitos sean morfológica e inmunofenotípicamente idénticos a los de la leucemia prolinfocítica.
Trastornos inmunológicos
En la LLC se asocian frecuentemente trastornos de la regulación inmune y fenómenos de autoinmunidad. Las enfermedades autoinmunes que usualmente se presentan son la AHAI y la púrpura trombocitopénica de naturaleza inmune. Con una frecuencia mucho menor se observa una aplasia selectiva eritropoyética o una neutropenia secundarias a la producción de autoanticuerpos dirigidos contra las células progenitoras de esas líneas medulares. La prueba de Coombs resulta positiva en el 15 al 35 % de los casos, ya sea al diagnóstico o durante la evolución de la enfermedad, pero no siempre se acompaña de AHAI. Alrededor del 10 al 20 % de las LLC presentan AHAI en algún momento de su evolución. En estos casos se observan numerosos microesferocitos y policromatofilia en la extensión de sangre periférica, aumento de la cifra de reticulocitos y hay un incremento eritropoyético en la médula ósea. Los anticuerpos suelen ser calientes de tipo IgG.
Las causas del incremento de autoanticuerpos contra los eritrocitos y las plaquetas en la LLC, no están completamente esclarecidas. Se ha señalado que es posible que estos autoanticuerpos no sean producidos por las células B leucémicas, pues existen evidencias de que las cadenas ligeras y los isotipos de las cadenas pesadas de estos autoanticuerpos (generalmente IgG con cadenas ligeras k y l) no están restringidas a las que presentan habitualmente las células B leucémicas (generalmente IgM o IgM/IgD y con sólo un tipo de cadena ligera). Por otra parte, se ha comprobado que la terapéutica inmunosupresora puede con frecuencia inducir la remisión del proceso autoinmune sin que se afecte significativamente la masa tumoral. Estas observaciones tomadas en su conjunto sugieren que estos autoanticuerpos no están directamente relacionados con las células malignas, sino que se producen por células B residuales no relacionadas con el clon leucémico.
Frecuentemente, los anticuerpos existentes en la LLC reaccionan con autoantígenos principalmente con IgG. Estos autoanticuerpos se han denominado «polirreactivos», pues son anticuerpos que se pueden unir a 2 o más antígenos diferentes, usualmente con baja afinidad. Sin embargo, se ha sugerido que las células B de la LLC no son las que producen directamente los autoanticuerpos, sino que lo hacen de una forma indirecta actuando como una célula presentadora de antígenos unidos específicamente a sus inmunoglobulinas de superficie.
En estos pacientes es frecuente la hipogammaglobulinemia; su prevalencia varía del 10 al 100 %, y se correlaciona con la duración de la enfermedad y el estadio en que se encuentra, pues es más frecuente en los pacientes con enfermedad avanzada. La Ig que está disminuida con mayor frecuencia es la IgM, seguida de la IgG y de la IgA. Entre el 5 y 10 % de los casos puede detectarse un componente monoclonal en el suero (frecuentemente IgM o IgG) que tiene las mismas características idiotípicas de las inmunoglobulinas de superficie de los linfocitos B. También se han descrito alteraciones del complemento y de la actividad fagocítica.
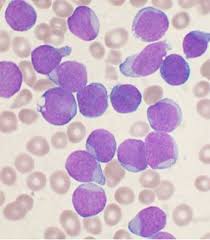
Morfología
Esta leucemia es considerada una enfermedad heterogénea teniendo en cuenta que su morfología celular no es siempre uniforme y que además puede presentar variaciones en sus características inmunofenotípicas, citogenéticas y moleculares. Por otra parte, existe gran variabilidad en su forma de presentación clínica y de evolución.
Desde el punto de vista morfológico, la LLC típica está representada por una población monoclonal de linfocitos pequeños y no más del 10 % de linfocitos grandes, prolinfocitos o células atípicas en sangre periférica o médula ósea.
Habitualmente se observan abundantes sombras de Gumprecht en la extensión de
sangre periférica. Se han señalado distintos subtipos de la enfermedad. Hace varios años se plantearon 2 variantes morfológicas además de la forma típica: una constituida por una población homogénea de linfocitos similares a los que se ven en las infecciones virales, cuyo citoplasma se adapta a la superficie de los hematíes, que se denominó de linfocitos activados, y otra en que existía una población de estas células junto a los linfocitos pequeños típicos. En la actualidad no se emplea esta clasificación. El grupo Franco-Americano-Británico (FAB) ha propuesto una clasificación de la LLC basada en la morfología de los linfocitos en sangre periférica: LLC típica donde más del 90 % de los linfocitos son pequeños y de aspecto maduro y las variantes consideradas de tipo mixto que incluyen el subtipo con aumento de prolinfocitos o células prolinfocitoides (LLC/LPL) en que el número de prolinfocitos está entre 11 y 54 %, y el subtipo llamado LLC atípica cuando existe heterogeneidad citomorfológica (linfocitos grandes, linfocitos hendidos, linfocitos granulares, inmunoblastos o eventualmente células linfoplasmocíticas), pero siempre con un número de prolinfocitos menor del 10 %.
Inmunofenotipo
Las células leucémicas son linfocitos B que tienen un inmunofenotipo definido por 3 características principales: comparten antígenos B (expresión débil de los antígenos CD19, CD20, CD22 y reactividad habitual con CD23) con fuerte positividad del antígeno T CD5 en ausencia de otros marcadores T; expresan sólo una cadena ligera de las inmunoglobulinas (k o l) y tienen una baja densidad de inmunoglobulinas de superficie (IgS) con una capacidad muy reducida de formación de casquetes en la superficie del linfocito. Estos elementos son adecuados para un diagnóstico preciso de la LLC y muy importantes para establecer el diagnóstico diferencial con otros síndromes linfoproliferativos crónicos.
En la mayor parte de los casos, expresan IgM de superficie con o sin IgD, raramente expresan IgG, IgA o IgD, o pueden expresar alteraciones tipo talasémicas de las IgS. Prácticamente en todos los casos se encuentra inmunoglobulina citoplasmática, incluyendo aquéllos que no expresan IgS.
Los linfocitos de la LLC forman rosetas espontáneas con los hematíes de ratón (rosetas M), que superan el 50 % cuando los linfocitos son tratados con neuraminidasa. Este es un marcador que resulta de gran utilidad. El grupo FAB lo ha propuesto dentro de los criterios de diagnóstico inmunológico de la LLC-B y ha planteado una cifra de al menos el 30 % para el diagnóstico.
Se ha señalado que casi todas las LLC expresan los antígenos CD5, DR, CD19, CD20 (a baja densidad), CD24, CD27, CD37, CD39, CD40, CD44, CD45RA, CDw75; muchas expresan también CD18, CD21 y CD23. Un número menor de casos expresan otros antígenos B. Los linfocitos de la LLC-B pueden en algunos casos coexpresar antígenos mielomonocíticos (CD11, CD13, CD14, CD15, CD33), y en pocas ocasiones algunos antígenos T asociados (CD1, CD2, CD3, CD4, CD8). Las células de la LLC-B expresan comúnmente bajos niveles de IgS al igual que de CD79a y Cd79b, que representan las moléculas accesorias del complejo constituido por el receptor inmunoglobulínico.
Se ha indicado que las alteraciones en la expresión de las moléculas de adhesión
influyen en los patrones de localización y diseminación hemoperiférica de los síndromes linfoproliferativos crónicos, por lo que su caracterización en los clones neoplásicos puede contribuir al diagnóstico y pronóstico de estos procesos. En diferentes síndromes linfoproliferativos se han observado alteraciones en la expresión de las moléculas de adhesión. Sin embargo, la presencia de diferentes patrones de expresión en varias muestras del mismo paciente, indica que la variabilidad entre las muestras puede depender de la etapa de maduración y activación, y aún de la función que desempeña determinada molécula de adhesión, lo que sugiere que el grado de expresión de estas moléculas en una determinada muestra está en dependencia del estado en que las células se encuentren en ese preciso momento.
Estudio Citogenético
Mediante las técnicas de bandas G se han puesto en evidencia anomalías cromosómicas aproximadamente en el 50 % de las LLC, que según algunos son más frecuentes en los casos en fases avanzadas.
Se ha señalado que la frecuencia de estas anomalías es mayor en las LLC clasificadas como de tipo mixto. Dentro de las alteraciones citogenéticas se ponen de manifiesto solamente anomalías únicas en más de la mitad de los casos, mientras que sólo aproximadamente en el 10 al 20 % se observan cariotipos complejos. El análisis de una amplia casuística mostró que la alteración más frecuente estaba representada por la trisomía 12, seguida de anomalías estructurales 13q y en orden decreciente 14q, anomalías del cromosoma 11, del cromosoma 6 y de los cromosomas 17, 1, 8, 7 y 18
Biología Molecular
La aplicación de las técnicas moleculares basadas en la hibridación del DNA ha permitido profundizar los conocimientos relacionados con la biología de las células leucémicas en la LLC. El estudio del reordenamiento de los genes de las inmunoglobulinas, que incluye el de las cadenas pesadas y ligeras, ha posibilitado la confirmación de la naturaleza clonal de esta enfermedad, y ha proporcionado un método más preciso para la identificación de la enfermedad mínima residual. La reciente introducción de la técnica de reacción en cadena de la polimerasa, procedimiento muy sensible, que es capaz de identificar una célula leucémica entre 105-106 células normales, ha hecho posible ampliar el concepto de remisión de la enfermedad hasta el grado de remisión molecular.
Hasta el momento no se ha demostrado la existencia de una alteración genética molecular asociada con el desarrollo de la LLC. La participación del oncogén BCL-2 en la génesis de la LLC ha sido objeto de múltiples estudios. Se ha señalado que en esta leucemia los linfocitos se acumulan en gran parte debido a una inhibición de la apoptosis secundaria a la sobreexpresión del gen BCL-2, aún cuando el reordenamiento de este gen es poco frecuente en esta enfermedad. En la LLC se han observado altos niveles de la proteína BCL-2 hasta en más del 85 % de los casos. Sin embargo, en un estudio reciente el gen estaba reordenado en sólo el 12 % de los enfermos. Estos datos hacen pensar en diversos mecanismos genéticos, hasta el momento sin esclarecer, que pueden intervenir en la desregulación de este oncogén en la LLC. Ningún otro oncogén comprometido en la patogenia de otros procesos linfoproliferativos B, como el BCL- 1, BCL-6, PAX-5 y MXC, se altera primariamente en la LLC.
Las variaciones de los reguladores del ciclo celular: p53, p15, p16, se asocian generalmente con formas clínicas agresivas o con la transformación en linfomas de células grandes. La inactivación del gen oncosupresor p53 se ha encontrado en un pequeño porcentaje de pacientes (10-20 %), pero esta modificación probablemente representa eventos moleculares asociados con la progresión o la transformación tumoral.38 Por otra parte, no se han comunicado aberraciones recurrentes de la p15 y la p16 en los procesos linfoproliferativos crónicos de tipo B.
Origen de la Célula Leucémica
La LLC se caracteriza por la acumulación de linfocitos B CD5+ y por una alta frecuencia de generación de fenómenos autoinmunes. Se ha señalado que estas características son el reflejo de las presentes en los linfocitos B CD5 normales. Esto último constituye una pequeña subpoblación de linfocitos B existente en los órganos linfáticos y la sangre de los adultos normales y en los tejidos linfoides del feto.
En el adulto, los linfocitos B CD5+ se pueden encontrar como elementos sésiles localizados en los bordes de los centros germinativos y en las zonas del manto que rodean los centros germinativos de los folículos secundarios. Sin embargo, las
características biológicas de las células CD5+ de la LLC y las de los linfocitos B normales CD5+ no son exactamente iguales, pues aunque existen múltiples semejanzas también hay algunas diferencias.
Los linfocitos B normales CD5+ entre otros caracteres, expresan generalmente niveles normales de inmunoglobulinas de superficie IgM, IgD, y excepcionalmente IgG, además pueden producir espontáneamente autoanticuerpos naturales IgM polirreactivos de baja afinidad y frecuentemente del tipo del factor reumatoideo, expresan idiotipos con reactividad cruzada e inmunoglobulinas con escasas o ninguna mutación somática, forman rosetas espontáneas con eritrocitos de ratón, expresan algunos antígenos mielomonocíticos y bajos niveles de CD20, se estimulan por el virus de Epstein-Barr (VEB) y expresan regularmente la proteína C-MYC. Estas células mantienen un adecuado sistema de transmisión de señales, con respuesta normal a la acción del Ca++ y del funcionamiento del mecanismo de intercambio Na+/H+, que es un paso fundamental en la transmisión de señales provenientes de muchos factores de crecimiento y de mitógenos.
Por otra parte, los linfocitos B CD5+ de la LLC, aunque conservan muchas de estas características, se diferencian de los normales en los siguientes rasgos principales: expresión de bajos niveles de inmunoglobulinas de superficie, lo que es un elemento distintivo de la LLC, resistencia la transformación por el VEB aún cuando ellos expresan el receptor celular para el virus (CD21), disminución de la transmisión de señales intracelulares que los incapacita para responder a diversos estímulos, marcada reducción de la función de intercambio Na+/H+ y de la estimulación por el Ca++.
Las células de la LLC expresan altos niveles de la proteína BCL-2 usualmente en ausencia de un reordenamiento del gen, lo que las hace resistentes a la apoptosis y pueden facilitar su acumulación progresiva, y además, baja expresión de Fas y ausencia de la proteína C-MYC. También se ha señalado que ellas se encuentran detenidas en la fase Go de su ciclo celular.
Aunque los linfocitos B normales CD5+ y los de la LLC comparten muchas características comunes, no tienen exactamente el mismo fenotipo, pues existen entre ellos muchos factores diferenciales. Por esto se ha sugerido que la contrapartida normal del linfocito de la LLC puede ser una subpoblación de los linfocitos normales CD5+ que durante su desarrollo fisiológico haya adquirido un fenotipo similar al de los de la LLC. Sobre esta base, se ha planteado la hipótesis de que la LLC sea una enfermedad ocasionada por el acúmulo de una subpoblación de linfocitos B CD5+ «anérgicos», que se encuentran fisiológicamente comprometidos en la producción de autoanticuerpos naturales. En este caso, el término anergia se usa para caracterizar a los linfocitos CD5+ que son funcionalmente inactivos después que han recibido una estimulación subóptima por autoantígenos. Normalmente, después que estas células son anergizadas por la exposición a autoantígenos solubles, se produce una disminución de la expresión de las inmunoglubulinas de superficie, tal como se ve en la LLC y adquieren además otras características peculiares de esta leucemia.
De acuerdo con esa hipótesis, la transformación del linfocito B normal CD5+ en el linfocito de la LLC se realiza a través de varios pasos sucesivos.
Inicialmente los linfocitos B normales CD5+ se transformarían en linfocitos CD5+ anérgicos, mediante una exposición subóptima a autoantígenos solubles, los que en etapas posteriores por estímulos aúndesonocidos sufrirían la transformación maligna, mediante la cual adquirirían una serie de propiedades como la incapacidad de responder al VEB, disminución funcional del intercambio Na+/H+, disminución de la transmisión de señales intracelulares, entre otras alteraciones que favorecen su acúmulo en la fase Go del ciclo celular.
Con toda seguridad, el extraordinario avance alcanzado en los últimos años en el campo científico-técnico, y en particular en el área de la biología molecular, permitirá en un futuro cercano esclarecer muchas de las interrogantes que aún se mantienen referentes al desarrollo de la célula leucémica de la LLC y los factores genéticos que en él intervienen.
Véase también:
Fuentes
- Montserrat E, López-Kartpovitch. Tratamiento de la leucemia linfocítica crónica, prolinfocítica y otros síndromes linfoproliferativos. En: Ruiz-Argüelles GJ, San Miguel JF, eds. Actualización en leucemias. México, DF: Editorial Médica Panamericana, 1996:107-13.
- Montserrat E. Leucemia linfática crónica: clínica, pronóstico y terapia. En: López Borrasca. Enciclopedia iberoamericana de Hematología, Salamanca: Universidad de Salamanca, 1992; vol 2:310-22.
- Montserrat E, Rozman C. Síndromes linfoproliferativos crónicos de expresión leucémica. En: Rozman C. Medicina interna, 12a ed Barcelona: Ediciones Doyma, 1992; vol 2: 1682-91.
- Villaescusa R, Borrego I, Merlín J, Hernández P. Estudio seriado del sistema complemento e inmunocomplejos circulantes en la leucemia linfoide crónica. Rev Cubana Hematol Immunol Hemoter 1989;5:37-44.
- Duque R, Orfao A. Utilidad del inmunofenotipo en el diagnóstico y clasificación de las leucemias crónicas. En: Ruiz-Argüelles GJ, San-Miguel eds. Actualización en leucemias. México, De: Editorial Médica Panamericana, 1996:89-96.