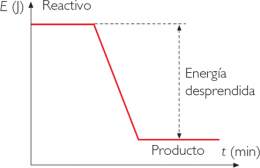
Reacción exotérmica
Reacción exotérmica: Es aquella reacción donde se libera calor, esto significa que la energía de las moléculas de los productos (EP) es menor que la energía de las moléculas de los reaccionantes (ER). En las reacciones químicas exotérmicas se desprende calor, el DH es negativo y significa que la energía de los productos es menor que la energía de los reactivos, por ejemplo en las reacciones de combustión.
Durante las reacciones químicas puede producirse absorción o liberación de energía. Esto indica que tanto los reaccionantes como los productos contienen calor que es característico de su masa. El contenido de calor es una medida de la energía que está acumulada por una sustancia durante su formación. La combustión del metano es una reacción de tipo exotérmico: CH4(g) + 2O2(g) CO2(g) + 2H2O(g) + 213 Kcal.
Energía calorífica y temperatura: Si una muestra de agua a una temperatura conocida (Temperatura inicial = Ti) se calienta durante un cierto tiempo, se observa un incremento de su temperatura. Al medir la nueva temperatura se obtiene la Temperatura final (Tf), la variación de la temperatura en la muestra se calcula restando la Tf menos la Ti y el resultado se denomina T.
Sumario
Clasificación de la reacción
La temperatura representa una medida de intensidad de calor, pero no es una medida de energía calorífica, pues la energía calorífica se expresa en calorías.
1 caloría es la cantidad de calor que absorbe 1 g de agua para elevar su temperatura de 14,5ºC a 15,5 ºC .
Así, el Calor: es la transferencia de energía entre dos sistemas a diferentes temperaturas. Al igual que el agua cada sustancia tiene una capacidad determinada para absorber calor, es decir tiene una capacidad calorífica propia.
Capacidad calorífica: es la cantidad de calor que se requiere para elevar a 1ºC la temperatura de 1 mol de sustancia.
Cuando se compara la capacidad calorífica de una sustancia con la del agua, que tiene el valor de la unidad, se obtiene un valor denominado calor específico. Calor específico (Ce): es la cantidad de calor necesaria para aumentar en 1ºC la temperatura de 1 gr de sustancia.
Reacción de la Energía
Todas las reacciones químicas están acompañadas por un cambio de energía. Algunas reacciones sueltan energía hacia sus alrededores (generalmente como calor) y son llamadas exotérmicas. Por ejemplo, el sodio y el cloro reaccionan tan violentamente que las llamas pueden ser vistas cuando la reacción exotérmica produce calor.
Las reacciones que prosiguen inmediatamente cuando dos substancias se mezclan (tal como la reacción del sodio con el cloro o la úrea con el cloruro de amonio) son llamadas reacciones espontáneas. No todas las reacciones proceden espontáneamente. Por ejemplo, piense en un fósforo. Cuando se enciende un fósforo se causa una reacción entre los químicos de la cabeza del fósforo y el oxígeno del aire. Pero el fósforo no se encenderá espontáneamente, primero necesita la entrada de la energía, llamada la energía activadora de la reacción. En el caso del fósforo, usted provee la energía activadora como el calor al golpear el fósforo en la caja. Después que la energía activadora se absorbe y la reacción empieza, la reacción continúa hasta que usted apague la llama o se le acabe el material que produce la reacción.
Es toda reacción química que desprende energía, es decir una variación negativa de entalpía.
Se da principalmente en reacciones de oxidación. Cuando ésta es intensa puede dar lugar al fuego. Cuando reaccionan entre sí dos átomos de hidrógeno para formar una molécula, el proceso es exotérmico. H· + H·→ H:H ΔH=-104 kcal/mol
Ejemplos de reacciones exotérmicas
- Paso de gas a líquido (condensación) y de líquido a sólido (solidificación)
- La combustión.
- Al unir hidróxido de sodio junto con azul de metileno y ácido acético igualmente ligado con azul de metileno. Al ir uniendo poco a poco la dos disoluciones irá creándose una especie de humo y poco a poco el vaso de precipitados se va poniendo algo caliente.