Reacción química
| ||||||
Reacción Química. También conocido como cambio químico. Proceso químico en el cual dos o más sustancias llamadas reaccionantes, por efecto de un factor energético, se transforman en otras sustancias llamadas productos. Esas sustancias pueden ser elementos o compuestos.
Sumario
Reacción Química
Se plantea que una Reacción química es un proceso en el cual una sustancia (o sustancias) desaparece para formar una o más sustancias nuevas. Las ecuaciones químicas son el modo de representar a las reacciones químicas.
Reactantes y productos
Para entenderlas y analizarlas, las reacciones químicas se representan mediante ecuaciones químicas. Los reactantes son sustancias que al combinarse entre ellas a través de un proceso llamado reacción química forman otras sustancias diferentes conocidas como productos de la reacción.
Características de las reacciones químicas
- Las sustancias nuevas que se forman suelen presentar un aspecto totalmente diferente del que tenían las sustancias de partida.
- Durante la reacción se desprende o se absorbe energía: Reacción exotérmica: se desprende energía en el curso de la reacción y Reacción endotérmica: se absorbe energía durante el curso de la reacción.
- Se cumple la ley de conservación de la masa: la suma de las masas de los reactivos es igual a la suma de las masas de los productos. Esto es así porque durante la reacción los átomos ni aparecen ni desaparecen, sólo se reordenan en una disposición distinta.
Importancia de las reacciones químicas
La importancia de las reacciones químicas es notoria en muchos aspectos de la vida diaria en fenómenos tales como explosiones; procesos vitales tales como alimentación, respiración etc. Todas las sustancias que a diario utilizamos son o fueron producto de reacciones químicas.
Estamos rodeados por reacciones químicas; tienen lugar en laboratorios, pero también en fábricas, automóviles, centrales térmicas, cocinas, atmósfera, interior de la Tierra... Incluso en el cuerpo humano ocurren miles de reacciones químicas a cada instante, que determinan lo que hacemos y pensamos.
Pasos que son necesarios para escribir una reacción química ajustada
- Se determina cuales son los reactivos y los productos.
- Se escribe una ecuación no ajustada usando las fórmulas de los reactivos y de los productos.
- Se ajusta la reacción determinando los coeficientes que nos dan números iguales de cada tipo de átomo en cada lado de la flecha de reacción, generalmente números enteros.
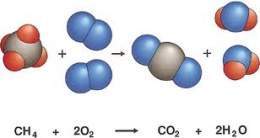
Ejemplo : Consideremos la reacción de combustión del metano gaseoso (CH4) en aire.
- Paso 1: Sabemos que en esta reacción se consume oxígeno (O2) y produce agua (H2O) y dióxido de carbono (CO2). Luego: los reactivos son CH4 y O2, y los productos son H2O y CO2
- Paso 2: La ecuación química sin ajustar será: CH4 + O2----- H2O + CO2
- Paso 3: Ahora contamos los átomos de cada reactivo y de cada producto y los sumamos: Entonces, una molécula de metano reacciona con dos moléculas de oxígeno para producir dos moléculas agua y una molécula de dióxido de carbono. CH4 + 2O2 = 2H2O + CO2
Clases ó tipos de reacciones químicas
Ahora bien, en miles de experimentos realizados en el mundo, debidamente repetidos y controlados en el laboratorio, las reacciones químicas se pueden clasificar en los siguientes tipos:
- REACCION DE COMPOSICIÓN O SÍNTESIS: En las reacciones de síntesis o composición es donde dos reactantes se combinan para formar un solo producto. Muchos elementos reaccionan con otro de esta manera para formar compuestos, por ejemplo:
2CaO(s) + 2H2O(l) ------- 2Ca(OH)2(ac)
En esta fórmula se mezclan 2 moles de óxido de calcio sólido con 2 moles de agua liquida reacciona produciendo 2 moles de dihidróxido de calcio acuoso.
- REACCION DE DESCOMPOSICION O ANÁLISIS: Este tipo de reacción es contraria a la de composición o síntesis ya que en esta no se unen 2 o mas moléculas para formar una sola, sino que una sola molécula se divide o se rompe para formar varias moléculas mas sencillas, por ejemplo:
2HgO (s)-------2Hg(l) + O2(g)
En esta fórmula una 2 molécula de óxido de mercurio sólido se descomponen o dividen para formar 2 moléculas de mercurio y una de oxígeno, las cuales son mas sencillas que la primera.
- REACCION DE DESPLAZAMIENTO O SUTITUCION: En este tipo de reacción, un elemento libre sustituye y libera a otro elemento presente en un compuesto, su ecuación general es:
CuSO4 + Fe------- FeSO4 + Cu
En esta reacción un mol de sulfato de cobre con 1 mol de hierro para formar sulfato de hierro y cobre.
- REACCION DE DOBLE SUTITUCION O DOBLE DESPLAZAMIENTO:Son aquellas reacciones que se dan por intercambio de átomos entre los reactivos.
AB + CD----------------- AC + BD
Por Ejemplo: K2S + MgSO4 ! K2SO4 + MgS
En esta reacción 1 mol de sulfuro de potasio reaccionan con sulfato de magnesio para formar sulfato de potasio y sulfuro de magnesio.
Es difícil encontrar reacciones inorgánicas comunes que puedan clasificarse correctamente como de doble sustitución.