Sustancias moleculares
| ||||
Sustancias moleculares: Prácticamente todas las sustancias que son gases o líquidos a 25 ºC y a la presión normal son moleculares.
Concepto
Una sustancia molecular es una sustancia formada básicamente por moléculas. Las sustancias moleculares generalmente poseen punto de fusión y ebullición menor que aquellos compuestos iónicos, las interacciones entre moléculas son muy pequeñas, consistiendo apenas de fuerzas de Van der Walls (fuerzas intermoleculares).
La gran variedad de sustancias presentes en la naturaleza se debe a la capacidad que los átomos tienen de combinarse entre sí, esta propiedad es denominada como enlace químico y puede suceder entre átomos de un mismo elemento o de elementos diferentes.
Molécula
Molécula es, por tanto, la menor combinación de átomos que mantienen la composición de la materia inalterada. Los átomos pueden unirse a través de enlaces químicos covalentes, iónicos o metálicos.
Los arreglos entre moléculas forman sustancias moleculares o compuestos moleculares. Esas sustancias se encuentran a temperatura ambiente en los tres estados físicos: sólido, líquido y gaseoso.
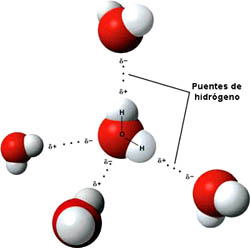
La molécula de agua es formada por el enlace entre dos átomos de hidrógeno (H) y un átomo de oxígeno (O). Esa molécula se encuentra en estado líquido y es representada por la fórmula H2O:
H ― O ― H
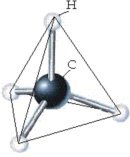
La molécula de metano está formada por el enlace entre un átomo de carbono (C) y cuatro átomos de hidrógeno (H), siendo representada por la fórmula CH4
El agua y el metano son sustancias moleculares, pues son formadas por moléculas. Además de estas, podemos citar como ejemplos de sustancias moleculares: el azúcar (de estado sólido), el alcohol (en estado líquido) y los gases en general (en estado gaseoso).
Propiedades
Fuerza intermolecular: A temperatura de ebullición (T.E.) de una molécula es influenciada por la interacción entre sus átomos (fuerzas de atracción intermoleculares): cuanto más intensa fuese la atracción entre las moléculas, mayor será la temperatura de ebullición.
Tamaño de las moléculas: El tamaño de un compuesto molecular también recibe influencia su punto de ebullición. Cuanto mayor fuese la sustancia, mayor será su superficie de contacto, debido al aumento de las interacciones entre las moléculas, consecuentemente la temperatura de ebullición va a aumentar.
Curiosidad
Las sustancias moleculares, están formadas por moléculas, en las que varios átomos se unen entre sí por enlaces covalentes. Las moléculas se unen entre sí por fuerzas intermoleculares que pueden ser:
• Enlace por puentes de hidrógeno.
• Fuerzas de Van der Waals, que pueden ser de dos tipos:
o Interaciones dipolares.
o Fuerzas dispersivas.
Estados de agregación
Al ser las fuerzas intermoleculares relativamente pequeñas las sustancias moleculares son, en general, gaseosas a temperatura ambiente y sólo en aquellos casos en que las fuerzas intermoleculares son más intensas se encuentran en estado líquido o gaseoso. En cualquier caso, los punto de fusión y ebullición son relativamente bajos y pueden explicarse teniendo en cuenta las fuerzas intermoleculares.
• Enlace por puentes de hidrógeno: aparecen cuando la molécula tiene átomos de hidrógeno unidos mediante enlace covalente a átomos de flúor, oxígeno o nitrógeno. Las sustancias que presentan enlaces por puentes de hidrógeno tienen unos puntos de fusión y ebullición especialmente elevados.
• Fuerzas de Van der Waals: Estas débiles fuerzas de interacción entre las moléculas también logran elevar los puntos de fusión y ebullición de las sustancias, pueden ser de dos tipos:
o Interacciónes dipolares: que aumentan al aumentar la polaridad de la molécula.
o Fuerzas dispersivas: que aumentan con la masa molecular de la sustancia.
Las fuerzas dispersivas se dan siempre, y si además las moléculas son polares, habrá también interacciones dipolares.
En sentido general las sustancias moleculares tienen bajos puntos de fusión y ebullición, por lo que se encuentran en estado gaseoso, pero a medida que las fuerzas intermoleculares son importantes, se encontrarán en estado líquido o gaseoso.