Teoría de Bronsted – Lowry
| ||||||
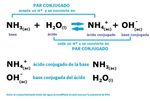
Teoría de Bronsted-Lowry. Una reacción ácido-base es cualquier reacción en la cual se transfiere un protón de un ácido a una base.
Características
- Un ácido de Brønsted-Lowry es cualquier especie capaz de donar un protón, H+\text{H}^+H+start text, H, end text, start superscript, plus, end superscript.
- Una base de Brønsted-Lowry es cualquier especie capaz de aceptar un protón, lo que requiere un par solitario de electrones para enlazarse a H+\text{H}^+H+start text, H, end text, start superscript, plus, end superscript.
- El agua es una sustancia anfótera, ya que puede actuar como un ácido de Brønsted-Lowry y como una base de Brønsted-Lowry.
- Los ácidos y bases fuertes se ionizan totalmente en solución acuosa, mientras que los ácidos y las bases débiles solo se ionizan parcialmente.
La teoría de Brønsted-Lowry describe las interacciones ácido-base en términos de transferencia de protones entre especies químicas. Un ácido de Brønsted-Lowry es cualquier especie que puede donar un protón, H+\text{H}^+H+start text, H, end text, start superscript, plus, end superscript, y una base es cualquier especie que puede aceptar un protón. En cuanto a estructura química, esto significa que cualquier ácido de Brønsted-Lowry debe contener un hidrógeno que se puede disociar como H+\text H^+H+start text, H, end text, start superscript, plus, end superscript. Para aceptar un protón, una base de Brønsted-Lowry debe tener al menos un par solitario de electrones para formar un nuevo enlace con un protón.
Peculiaridad
Según la definición de Brønsted-Lowry, una reacción ácido-base es cualquier reacción en la cual se transfiere un protón de un ácido a una base. Podemos utilizar las definiciones de Brønsted-Lowry para discutir las reacciones ácido-base en cualquier disolvente, así como las que ocurren en fase gaseosa. Por ejemplo, consideremos la reacción del gas del amoniaco, NH3(g)\text{NH}_3(g)NH3(g)start text, N, H, end text, start subscript, 3, end subscript, left parenthesis, g, right parenthesis, con cloruro de hidrógeno gaseoso, HCl(g)\text{H}\text{Cl}(g)HCl(g)start text, H, end text, start text, C, l, end text, left parenthesis, g, right parenthesis, para formar Cloruro de Amonio sólido, NH4Cl(s)\text{NH}_4 \text{Cl}(s)NH4Cl(s)start text, N, H, end text, start subscript, 4, end subscript, start text, C, l, end text, left parenthesis, s, right parenthesis
Véase también
Fuentes
- Disponible en:Teoría de Bronsted.
- Disponible en:Bronsted.