Amoníaco
| ||||||||||||||||
Amoníaco. Compuesto químico de nitrógeno con la fórmula química NH3. Es un gas incoloro con un característico olor repulsivo. El amoníaco contribuye significativamente a las necesidades nutricionales de los organismos terrestres por ser un precursor de fertilizantes. Directa o indirectamente, el amoníaco es también un elemento importante para la síntesis de muchos fármacos y es usado en diversos productos comerciales de limpieza. Pese a su gran uso, el amoníaco es cáustico y peligroso. La producción industrial del amoníaco en 2012 fue de 198 000 000 toneladas, lo que equivale a un 35 % de incremento con respecto al año 2006, con 146 500 000 toneladas.
Sumario
- 1 Etimología
- 2 Historia
- 3 Propiedades
- 4 Usos
- 5 Efectos nocivos en el organismo
- 6 Tratamiento en los pacientes
- 7 Papel del amoníaco en sistemas biológicos y en enfermedades humanas
- 8 En astronomía
- 9 Bibliografías
- 10 Fuentes
Etimología
Su nombre fue dado por el químico sueco Torbern Bergman al gas obtenido en los depósitos de sal cerca del templo de Amón, en Libia y viene del griego, ammōniakón, que significa lo perteneciente a Amón.
Historia
Los Romanos le dieron el nombre de 'sal ammoniacus' (sal de amoníaco) a los depósitos de cloruro de amoníaco colectados cerca del templo de Amun (en griego Ἄμμων" Ammon) en la antigua Libia por la proximidad del templo. Las sales de amoníaco se conocen desde tiempo antiguos; así es que el término de "Hammoniacus sal" aparece en las escrituras de Plinio, aunque no se sabe si el término es idéntico al término moderno de "sal-ammoniac" (cloruro de amonio).
En la forma de sal de amoníaco, el amoníaco fue importante en la alquimia medieval, como en el siglo XVIII, se mencionó por químico Persa Jābir ibn Hayyān, y los alquimistas desde el siglo XIII, siendo mencionado por Albertus Magnus. También fue utilizado por tintoreros en la Edad media en forma de orina fermentada para alterar el color de los tintes vegetales. En el siglo XV, Basilius Valentinus demostró que el amoníaco podía ser obtenido por la acción de álcalis en sal de amoníaco. En un periodo posterior, cuando las sales de amoníaco se obtenían de la destilación de pezuñas y cuernos de los bueyes y neutralizando el carbonato resultante con ácido clorhídrico.
El amoníaco gaseoso fue aislado por primera vez por Joseph Priestley en 1774 y fue nombrado por él como "aire alcalino". Once años después en 1785, Claude Louis Berthollet encontró su composición.
El proceso de Haber-Bosch produce amoníaco desde el nitrógeno en el aire, el cual fue desarrollado por Fritz Haber y Carlo Bosch en 1909 y la patentaron en 1910. Su primer uso fue en una escala industrial en Alemania durante Primera Guerra Mundial. El amoníaco fue usado para producir explosivos para sostener refuerzos de guerra. Sin embargo, a pesar de su origen con fines bélicos, el proceso ha llegado a ser la principal fuente de nitrógeno fijado en el mundo, mejorando el rendimiento de los cultivos y mitigando el hambre a millones de personas en el planeta.
Anterior a la disponibilidad del gas natural barato, el hidrógeno como precursor de la producción de amoníaco se llevaba a cabo con electrolisis del agua o usando el proceso de cloro-álcali.
Propiedades
El amoníaco es un gas incoloro con un olor desagradable. Es más ligero que el aire, su densidad es 0.589 veces la del aire de la atmósfera. Se condensa fácilmente por sus fuertes puentes de hidrógeno entre las moléculas; el líquido hierve a –33.3 °C y se congela a los –77.7 °C en cristales blancos. El amoníaco se puede desodorizar fácilmente reaccionando con bicarbonato de sodio o ácido acético. Ambas reacciones forman sales de amoníaco sin olor.
Sólido La simetría del cristal es cúbico, su símbolo pearson es CP16, grupo espacial P 213 No.198, constante de red 0.5125 nm.
Líquido El amoníaco líquido posee fuertes fuerzas ionizantes reflejando su alta constante dieléctrica de 22. El amoníaco líquido tiene una muy alta entalpía de vaporización (23.35 kJ/mol, cf. agua 40.65 kJ/mol, metano 8.19 kJ/mol, fosfina 14.6 kJ/mol) y puede ser usado en laboratorios en vasos no aislados sin refrigeración.
Solubilidad en agua
El amoníaco es miscible con agua. En una solución acuosa puede separarse por ebullición. La solución acuosa de amoníaco es una base. La concentración máxima de amoníaco en agua tiene una densidad de 0.880 g/cm3 (880 kg/m3) y es frecuentemente conocido como 'amoníaco 0.880'. El amoníaco casero o hidróxido de amonio es una solución de NH3 en agua. La concentración de dicha solución es medida en unidades de la Escala Baumé, con 26 grados baumé (cerca del 30 % por peso de amoníaco) como concentración típica del producto comercial.
Combustión
El amoníaco no se quema ni sostiene la combustión por sí mismo, excepto en mezclas de combustible con el 15 a 25 % de aire. Cuando se mezcla con oxígeno se quema con una llama de color verde amarillento pálido. A alta temperatura y en la presencia de un catalizador, el amoníaco se descompone en sus elementos constituyentes. La combustión ocurre cuando la clorina pasa a amonio, formando nitrógeno y cloruro de hidrógeno; si la clorina está en exceso, se forma el explosivo tricloruro de nitrógeno (NCl3).
Estructura
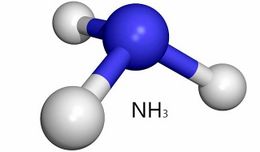
La molécula de amoníaco tiene una forma trigonal piramidal, como lo predice la teoría de repulsión de los pares de electrones de la capa de valencia, con un ángulo de enlace determinado de 106.7º. El átomo central de nitrógeno tiene cinco electrones externos con un electrón adicional de cada átomo de hidrógeno. Esto da un total de ocho electrones, o cuatro pares de electrones que son acomodan tetraédricamente. Tres de esos pares de electrones se usan como enlaces pares, lo que deja un par de electrones libres. Este par repele más fuertemente los pares de enlaces, entonces el ángulo del enlace no es de 109.5º como se esperaría por un acomodo tetraedral, sino de 106.7º. El átomo de nitrógeno en la molécula tiene un par de electrones libres, lo cual provoca que el amoníaco sea una base, aceptador de protones. Esta forma le da a la molécula un momento dipolo y lo hace una molécula polar. La polaridad de la molécula y, especialmente, su habilidad para formar puentes de hidrógeno, hace que el amoníaco sea altamente miscible en agua. El amoníaco es moderadamente básico, una solución acuosa a 1 M tiene un pH de 11.6 y si un ácido fuerte es agregado a la solución hasta que la solución alcance un pH neutral de (pH=7), 99.4 %, las moléculas amoníaco se protonan. La temperatura y la salinidad también afectan la proporción de NH4+. Lo resultante tiene una forma regular y es isoelectrónico con metano.
La molécula de amoníaco fácilmente experimenta inversión del nitrógeno a temperatura ambiente; una analogía útil es que cuando una sombrilla gira al revés en un fuerte viento. La barrera de energía a esta inversión es de 24.7 kJ/mol, y la frecuencia resonante es de 23.79 Hz, correspondiente a la radiación de un microondas con una longitud de onda de 1.260 cm. La absorción a esta frecuencia fue la primera espectroscopia de microondas observada.
Anfotericidad
Una de las características más importantes del amoníaco es su basicidad. El amoníaco es considerado una base débil. Se combina con ácidos para formar sales; con ácido clorhídrico forma cloruro de amonio; con ácido nítrico, nitrato de amonio, etc. De cualquier modo, el amoníaco perfectamente seco no se combina con cloruro de hidrógeno completamente seco; el agua es necesaria para que se lleve a cabo la reacción. Como una demostración del experimento, las botellas abiertas con amoníaco concentrado y ácido clorhídrico producen nubes de cloruro de amonio, que parecen salir "de la nada" mientras las sales forman donde se encuentran las dos nubes de difusión de las moléculas, entre las dos botellas.
NH3 + HCl → NH4Cl
Las sales producidas por acción del amoníaco en ácidos son conocidos como compuesto de amonio, los cuales contienen el ion de amonio. (NH4+).
Aunque el amoníaco es conocido como base débil, también funciona como un ácido muy débil. Es una sustancia prótica si es capaz de formar aminas (las cuales contienen el ion NH2−). Por ejemplo, el litio disuelto en amoníaco líquido para dar una solución de litio amina.
Li + NH3 → LiNH2 + ½ H2
Autodisociación
Así como el agua, el amoníaco sufre autoionización molecular para formar sus bases y ácidos conjugados.
2 NH3 (aq) NH+4 (aq) + NH−2 (aq)
En presión y temperatura estándar, K=[NH+4][NH−2]=10−30
Combustión
La combustión del amoníaco da nitrógeno y agua es una reacción exotérmica:
4 NH3 + 3 O2 → 2 N2 + 6 H2O (g) (ΔH°r = −1267.20 kJ/mol)
El poder calorífico, ΔH°c, expresado por mol de amoníaco y formando condensación de agua, es -382.81 kJ/mol. El dinitrógeno es el producto termodinámico de una combustión del amoníaco: todos los óxidos de nitrógeno son inestables con respecto a N2 and O2, el cual es el principio que está detrás del convertidor catalítico. Como sea, los óxidos de nitrógeno pueden ser formados por productos cinéticos en la presencia de una catálisis apropiada, una reacción de gran importancia industrial en la producción de ácido nítrico:
4 NH3 + 5 O2 → 4 NO + 6 H2O
Una reacción subsecuente lleva NO2
2 NO + O2 → 2 NO2
La combustión de amoníaco en aire es muy difícil en la ausencia de un catalizador, pues la temperatura de la llama es normalmente menor que la de encendido de la mezcla de amoníaco con aire. El rango inflamable del amoníaco en el aire es del 16 % al 25 %.
Formación de otros compuestos
En química orgánica, el amoníaco puede actuar como nucleófilo en reacciones de sustitución nucleofílica. Se pueden formar aminas por la reacción del amoníaco con haloalcanos, aunque el -NH2 resultando es también nucleofílico y aminas secundarias y terciarias se forman como subproductos. Un exceso de amoníaco ayuda a minimizar sustituciones múltiples, y neutraliza a los haluros de hidrógenos formados. La metilamina es preparada comercialmente por la reacción de amoníaco con clorometano, y la reacción de amoníaco con ácido 2-bromopropanoico se ha usado para preparar alanina racémica en un rendimiento al 70 %. La etanolamina se prepara por una reacción de oxidación con etileno: la reacción a veces permite producir dietalonamina y trietalonamina.
Las amidas pueden ser preparas por una reacción de amoníaco con derivados ácidos carboxílicos. El cloruro de acilo es el más reactivo, pero el amoníaco debe estar presente en al menos el doble para neutralizar el ácido clorhídrico formado. Los ésteres y anhídridos también reaccionan con el amoníaco para formar amidas. Las sales amonio de ácidos carboxílicos pueden estar deshidratadas en amidas tanto tiempo que no haya térmicamente grupos sensitivos presentes: temperaturas de 150 °C a 200 °C son requeridas.
El hidrógeno en el amoníaco puede ser reemplazado por metales, así el magnesio quema en el gas con la formación de nitrato de magnesio Mg3N2, y cuando el gas pasa sobre sodio o potasio sobre calentado, sodamida, NaNH2, y potasamida, KNH2, se forman. Donde necesariamente en nomenclatura IUPAC, se prefiere "azano" como nombre del anomíaco: por lo tanto la cloramina se llamaría "cloroazano", no cloroamoníaco.
El amoníaco pentavalente es conocido como λ5-amino, o más comúnmente como hídrico de amonio. Es sólido cristalino es estable solamente en altas presiones, y se descompone de nuevo en amoníaco trivalente y gas hidrógeno en condiciones normales. Se ha investigado esta sustancia como posible combustible en 1966.
Amoníaco como ligando
El amoníaco puede funcionar como un ligando en complejo de metales de transición. Es un donor-σ, en medio de las series espectroquímicas, y muestra un comportamiento intermedio en duro-blando. Algunos complejos de amoníaco incluyen 'tetraamminediaquacopper'([Cu(NH3)4(H2O)2]2+), ([Ag(NH3)2]+) que es la especie activa del agente de Tollen's. La formación de este complejo también puede distinguirse entre precipitados de diferentes haluros de plata: cloruro de plata (AgCl) es soluble en una solución de amoníaco diluido (2M), el bromuro de plata (AgBr) es soluble solo en una solución de amoníaco concentrado, donde el yoduro de plata (AgI) es insoluble en amoníaco líquido.
Los complejos de cromo se conocieron en el siglo XIX, y formaron la base de la teoría revolucionaria de Alfred Werner, sobre la estructura de la coordinación de compuestos. Werner notó solamente dos isómeros ("fac"- y "mer"-) del complejo [CrCl3(NH3)3] puede formarse, y concluyó que los ligados deben estar acomodados alrededor de los iones de metales en los vértices de un octahedron. Esta propuesta ha disido confirmada desde entonces por la cristalografía de rayos X.
Un amoníaco ligando unido a un ion metal es marcadamente más ácido que una molécula libre de amoníaco, aunque la desprotonación en una solución acuosa aún es rara. Un ejemplo es la reacción Calomel:
Hg2Cl2 + 2 NH3 → Hg + HgCl (NH2) + NH4+ + Cl−
Amoníaco en teoría de grupos
El grupo puntual para amoníaco es C3v cuando el eje mayor va a través del nitrógeno vertical. Cuando el eje mayor esta hilado ya sea en sentido de las manecillas del reloj o al contrarió, en 120º, cada hidrógeno se mueve en la locación previa de otro hidrógeno. Otro aspecto del grupo puntal de C3v incluye tres planos verticales de simetrías que intercepta al nitrógeno y a uno de los hidrógenos permitiendo a los otros dos que se reflejen el uno con otro. La matriz matemática para este subgrupo particular es complicado desde que las matrices producidas por las rotaciones o las reflexiones son reducibles comparadas a otras matrices que son irreducibles. Por eso, una transformación similar debe ser hecha en cada porción de la matriz que es reducible. La transformación similar para el amoníaco viene de los cálculos del diagrama orbital molecular de simetría adaptado a una combinación lineal para la contribución de enlaces de cada uno de los hidrógenos.
Usos
Fertilizante
Aproximadamente el 83 % del amoníaco en el 2004 se utilizaba como fertilizantes o sales, soluciones o anhídridos. Cuando se aplicaba en suelo, ayudaba a incrementar el rendimiento de los cultivos como el maíz y el trigo. El 30 % del nitrógeno agricultural usado en los Estados Unidos es en forma de anhídrido y en el mundo, 110 millones de toneladas se usan cada año.
Precursor de compuestos de nitrógeno
El amoníaco es directa o indirectamente el precursor de la mayor parte de los compuestos que contienen nitrógeno. Virtualmente, todos los compuestos sintéticos de nitrógeno son derivados del amoníaco. Uno de los derivados más importantes el ácido nítrico. El material clave se genera gracias al proceso de Ostwald por oxidación de amoníaco con aire sobre un catalizador de platino, con una temperatura entre 700 °C y 800 °C y 9 atmósferas. El óxido nítrico es un intermediario en esta reacción.
NH3 + 2 O2 → HNO3 + H2O
El ácido nítrico es usado para la producción de fertilizantes, explosivos, etc.
Limpiador
El amoníaco casero es una solución de NH3 en agua (hidróxido de amoníaco) usado con el propósito de limpiar superficies. Uno de sus usos más comunes es limpiar cristal, porcelana y acero inoxidable. También se usa frecuentemente para limpiar hornos y absorbiendo elementos para ablandar en la suciedad. El amoníaco casero tiene una concentración peso de 5 a 10 % de amoníaco.
Fermentación
Soluciones de amoníaco de entre el 16 % y el 25 % se usan en fermentaciones industriales como fuente de nitrógeno para microorganismos y ajustar su pH durante la fermentación.
Agente antimicrobiano para alimentos
En 1895, se sabía que el amoníaco era un antiséptico fuerte. Por esto se requiere 1.4 gramos por litro para preservar el caldo. En un estudio, amoníaco anhídrido destruyó 99.999 % de bacterias zoonóticas (Zoonosis) en tres tipos de alimento para animales. El anhídrido de amoníaco se usa actualmente para eliminar contaminación microbiana. La baba rosa está hecha de recortes de carne grasosos removiéndoles la grasa con calor y centrifugación, luego tratándolo con amoníaco para matar a las E. coli en niveles indetectables. Ha habido preocupaciones sobre la seguridad del proceso, así como las quejas de los consumidores sobre el sabor y su mal olor.
Fertilizante agrícola
En forma de amoníaco anhidro tiene un uso como fertilizante aumentando los niveles de nitrógeno del suelo.
Usos menores y emergentes
Refrigeración - R717
Gracias a las propiedades de vaporización del amoníaco, es útil como un refrigerante. Era usado comúnmente antes de la popularización del empleo de los compuestos clorofluorocarbonados. El amoníaco anhídrido es usado incansablemente en la industria de la refrigeración y para los pistas de hockey por su alta eficiencia de conversión de energía y bajo costo. No obstante, tiene la desventaja de ser tóxico, lo que le restringe su uso doméstico y a pequeña escala. Junto con su uso moderno de refrigeración por compresión de vapor, se utilizó junto con hidrógeno y agua en refrigeración de absorción. El ciclo de Kalina, depende ampliamente del rango de ebullición de la mezcla de amoníaco y agua.
Para remediación de emisión de gases
El amoníaco es usado para depurar SO2 de combustibles calientes, y el producto resultante es convertido sulfato de amoníaco para usarse como fertilizando. El amoníaco neutraliza la contaminación de los óxidos de nitrógenos (NOx) emitidos por los motores diesel. Esta tecnología, llamada SCR (Reducción Selectiva Catalítica), se basa en un catalizador a base de vanadio.
El amoníaco puede ser usado para mitigar derrames de gases de fosgeno.
Como combustible
El amoníaco fue usado durante la Segunda Guerra Mundial como combustible para camiones en Bélgica, y su motor y energía solar mayor a 1900. El amoníaco líquido también fue combustible de los motores de reacción XLR99 que prenderían X-15. Aunque no es un combustible fuerte, no deja duda en el uso del motor del cohete y su densidad aproximada coincide con la densidad del oxidante, oxígeno líquido, lo cual simplificó el diseño de la aeronave.
El amoníaco se ha propuesto como una alternativa práctica al combustible fósil para la combustión de motores internos. El valor calorífico del amoníaco es 22.5 Mj/kg, que es aproximadamente la mitad del diesel. Un motor normal, en el cual el vapor del agua no se condensa, el valor calorífico el amoníaco sería menos del 21 %.
El amoníaco no puede ser usado fácilmente en el ciclo de Otto por sus bajos niveles de octano. Aunque con la menor de las modificaciones a los carburadores y una reducción drástica en el radio de compresión, lo cual requeriría nuevos pistones, un motor de gasolina puede funcionar exclusivamente con amoníaco, en una fracción baja de su poder antes de la conversión del consumo de combustibles más potentes.
El tanque de un automóvil puede almacenar amoníaco líquido siempre y cuando el tanque este presurizado apropiadamente, dependiendo de la temperatura. Dependiendo de las propiedades termodinámicas del amoníaco son tales que a -30 °C, la presión del tanque tendría que ser 27.5 psi, aproximadamente lo mismo que un neumático de un carro. A 30 °C tendría que ser 170 psi para mantener el amoníaco líquido. Si la presión del tanque fuera liberada, el amoníaco líquido se tornaría gaseoso y alzar la presión a ese nivel. Los compresores comunes de aire de neumáticos operan a esta presión, para que la presión del tanque no sea una barrera para el uso del combustible.
Como sea, hay otras barreras para extender su uso. En términos de suministros primos de amoníaco, las plantas tendrían que ser construidas para incrementar los niveles de producción, lo cual requeriría una inversión mayor monetaria y energética. Aun cuando es el segundo compuesto químico más producido, la escala de producción de amoníaco es una pequeña fracción del petróleo usado en el mundo. Puede ser manufacturo de energías renovables, así como la energía nuclear. Noruega produjo amoníaco con electrólisis de agua por muchos años desde 1913, produciendo fertilizando por Europa. Si se produce del carbono, el CO2 puede ser embargado, pero la captura y almacenamiento de las plantas de carbono aún no llegan ni a la fase de prototipo.
En 1981, una compañía canadiense convirtió un Chevrolet Impala 1981 para que funcionara con amoníaco. Desde Detroit hasta San Francisco con una sola recarga de amoníaco.
Los motores de amoníaco que usan el amoníaco como un fluido de trabajo, se han propuesto y usado ocasionalmente. El principio es similar al que se usa como locomoción, pero con el amoníaco se usa un fluido, en lugar de aire comprimido. Los motores de amoníaco se han usado experimentalmente en el siglo XIX por Goldsworthy Gurney en el Reino Unido y en Nueva Orleans.
Como estimulante
El amoníaco, como vapor liberado por sales aromáticas, tiene un uso importante como estimulante respiratorio. El amoníaco es comúnmente usado en la manufactura ilegal de metanfetaminas a través de una reducción de Birch. El método Birch para hacer metanfetamina es peligroso porque son extremadamente reactivos los metales alcalinos y el amoníaco líquido, y la temperatura líquida del amoníaco lo hace susceptible a explotar cuando las reactivas son añadidas.
En la Industria Textil
El amoníaco líquido es usado para el tratamiento de materiales de algodón, dándole propiedades como mercerización, usando metales álcalis, se usa para prelavar lana.
Gas de levantamiento
En una presión y temperatura estándar, el amoníaco es menos denso que una atmósfera, y tiene aproximadamente 60 % de poder de levantamiento del hidrógeno o helio. El amoníaco se usa a veces para llenar globos meteorológicos como un gas de levantamiento, por su relativo alto punto de ebullición (comparado al helio o hidrógeno), el amoníaco potencialmente pude ser refrigerado y licuado en una nave para reducir la elevación y añadir lastre (y regresarlo como gas con el mismo fin).
Tratamiento de la madera
El amoníaco también se usa para oscurecer madera del roble blanco en muebles. Los vapores de amoníaco reaccionan con los taninos naturales en la madera, provocando un cambio de color.
Efectos nocivos en el organismo
Inhalación
En concentraciones elevadas irrita la garganta, inflama los pulmones, daña las vías respiratorias y los ojos. Según aumenta la concentración puede llegar a producir edema pulmonar. El edema pulmonar a menudo es causado por insuficiencia cardíaca congestiva. Cuando el corazón no es capaz de bombear sangre al cuerpo de manera eficiente, ésta se puede represar en las venas que llevan sangre a través de los pulmones hasta el lado izquierdo del corazón. A medida que la presión en estos vasos sanguíneos se incrementa, el líquido es empujado hacia los espacios de aire (alvéolos) en los pulmones. Este líquido reduce el movimiento normal del oxígeno a través de los pulmones. Esto y el aumento de la presión pueden llevar a dificultad para respirar) o la muerte cuando supera las 5000 ppm. Si la persona inhaló el tóxico, trasládela inmediatamente a un sitio donde pueda tomar aire fresco, e inmediatamente después acudir rápidamente al médico.
Contacto con la piel
El amoníaco puede producir irritación de la piel, sobre todo si la piel se encuentra húmeda. Además, puede llegar a quemar y ampollar la piel al cabo de unos pocos segundos de exposición con concentraciones atmosféricas superiores a 300 ppm. Si el químico está en la piel o en los ojos, enjuague con agua abundante al menos por 15 minutos.
Ingestión
Este compuesto es gaseoso en condiciones atmosféricas normales siendo poco probable su ingestión. Sin embargo, en caso de producirse, puede destruir la mucosa gástrica, provocando severas patologías e incluso la muerte. Si la persona ingirió el químico, suminístrele agua o leche inmediatamente, a menos que el médico haya dado otras instrucciones. No suministre leche ni agua si el paciente presenta síntomas que dificulten la deglución (problemas al tragar), tales como vómitos, convulsiones o disminución de la lucidez mental.
Tratamiento en los pacientes
- Broncoscopia: colocación de una cámara a través de la garganta para observar las quemaduras en las vías respiratorias y en los pulmones.
- Endoscopia: colocación de una cámara a través de la garganta para observar las quemaduras en el esófago y el estómago.
- Líquidos por vía intravenosa (IV).
- Medicamentos para tratar los síntomas.
- Medicamento para neutralizar el efecto del tóxico (un antídoto).
- Oxígeno y soporte respiratorio.
- Desbridamiento cutáneo (extirpación quirúrgica de la piel quemada).
- Lavado de la piel (irrigación), quizá con intervalos de pocas horas durante varios días.
Papel del amoníaco en sistemas biológicos y en enfermedades humanas
El amoníaco es una importante fuente de nitrógeno para sistemas vivos. Aunque el nitrógeno atmosférico abunda (más del 75 %), algunas criaturas vivas son capaces de usar el nitrógeno atmosférico en su forma diatómica, N2 gas. Entonces, la fijación de nitrógeno es requerida para la síntesis de aminoácidos, los cuales son la base de la proteína. Algunas plantas usan el amoníaco del nitrógeno atmosférico.
Biosíntesis
En determinados organismos, el amoníaco es producido por el nitrógeno atmosférico por la enzima llamada nitrogenasa. El proceso general se llama fijación de nitrógeno. Aunque difícilmente los métodos biomiméticos sean competitivos con el "Proceso de Haber", un esfuerzo intenso se ha direccionado hacia el mecanismo biológico de fijación de nitrógeno. El interés científico en este problema es motivado por una estructura inusual del sitio activo de la enzima, que consiste de un conjunto Fe7MoS9.
También es un producto metabólico de los aminoácidos, catalizador por enzimas como la Glutamato deshidrogenasa. La excreción de amoníaco es común en animales marinos. En humanos, es fácilmente convertido a urea, que es menos tóxica, así como menos básica. La urea es el mayor componente del peso seco de la orina. La mayoría de los reptiles, aves, insectos y caracoles secretan ácido úrico como desechos nitrogenados.
En fisiología
El amoníaco también juega un papel en las fisiologías normal y anormal. Es biosintetizado a través del metabolismo normal de los aminoácidos y es tóxico en altas concentraciones. El hígado convierte amoníaco a urea a través de varias series de reacciones conocidas como el ciclo de la urea. Disfunciones en el hígado, como la cirrosis, pueden llevar tener una cantidad alta de amoníaco en la sangre (hiperamonemia). Del mismo modo, defectos en la enzima responsable del ciclo de la urea, como la ornitina transcarbamilasa, pueden provocar hiperamonemia. La hiperamonemia lleva a la confusión y a un estado de coma de encefalopatía hepática, así como las enfermedades comunes en personas con problemas en el ciclo de la urea.
Es importante para el balance normal ácido/base. Después de la formación de amonio de glutamina, α-cetoglutarato puede ser degradado para producir dos moléculas de bicarbonato, los cuales funcionan posteriormente como buffers para ácidos dietéticos. El amoníaco es excretado en la orina, perdiendo ácidos. El amoníaco puede difundirse a través de sí mismo los túmulos renales, combinado con iones de hidrógeno, para permitir futura excreción de ácidos.
Excreción
Los iones de amoníaco son productos tóxicos desechados del metabolismo de animales. En peces e invertebrados acuáticos, se excreta directamente al agua. En mamífero, tiburones y anfibios, se convierte en el ciclo de la urea a urea, porque es menos tóxico y es un proceso eficiente. En aves, reptiles y caracoles terrestres, el amonio metabólico es convertido en ácido úrico, que es sólido, y por tanto es excretado con una pérdida mínima de agua.
En astronomía
El amoníaco se ha detectado en la atmósfera de los planetas de gas gigante, incluyendo Júpiter, junto con otros gases como el metano, hidrógeno y helio. En el interior de Saturno hay cristales congelados de amoníaco. Se encuentra naturalmente en las lunas Deimos y Phobos, las dos lunas de Marte.
Espacio interestelar
El amoníaco fue detectado en un principio en el espacio en 1968, basado en emisiones de microondas desde la dirección del núcleo galáctico. Esta fue la primera molécula poliatómica detectada. La sensibilidad de la molécula en un amplio rango de excitaciones y la facilidad con que se puede observar un número de regiones ha hecho al amoníaco una de las moléculas más importantes para los estudios de las nubes moleculares. La relativa intensidad de líneas de amoníaco puede ser usada para medir la temperatura del medio emisor.
Las siguientes especies isotópicas de amoníaco se han detectado:
NH3, 15NH3, NH2D, NHD2, y ND3
La detección del triple deuterio amoníaco fue considerado una sorpresa fue el deuterio es relativamente escaso. Se cree que las bajas temperaturas permiten a esa molécula subsistir y acumularse.
Desde su descubrimiento interestelar, NH3 ha probado ser una herramienta espectroscopia invaluable en el estudio del medio interestelar. Con un largo número de transiciones, es sensible a un amplio rango de condiciones de excitación, NH3 ha sido ampliamente detectado astronómicamente -su detección ha sido reportada en cientos de artículos.
El estudio del amoníaco interestelar ha sido importante para diversas áreas de investigación en las últimas décadas.
Formación interestelar y mecanismos
[Ag(NH3)2]+
La abundancia interestelar para el amoníaco ha sido medida en varios ambientes. El radio de [NH3]/[H2] ha sido estimado desde 10−7 en pequeñas nubes oscuras hasta 10−5 en el denso núcleo del complejo de nube molecular de Orión. Aunque un total de producción total de 18 rutas ha sido propuesta, el principal mecanismo para formar NH3 interestelar es la siguiente reacción:
NH4+ + e− → NH3 + H•
La constante de cambio "k" en esta reacción depende de la temperatura del ambiente, con un valor de 5.2×10−6 a 10 K. La constante fue calculada de la fórmula "k = a(T/300)B". Para la reacción de formación primaria, a = 1.05×10−6 y B = −0.47. Asumiendo una abundancia de NH4+ de 3×10−7 y una abundancia de electrones de 10−7 típico de nubes moleculares, la formación procede a un cambio de 1.6×10−9 cm−3s−1 en una nube molecular con una densidad total de 105 cm−3.
Todas las demás propuestas de reacción de formación tienen constantes con valores entre 2 y 13 órdenes de magnitudes menores, haciendo que las contribuciones a la abundancia del amoníaco sean relativamente insignificantes. Como ejemplo de una de las contribuciones mencionadas está:
H2 + NH2 → NH3 + H
Tiene un cambio constante de 2.2×10−15. Asumiendo que las densidades de 105 and NH2/H2 ratio of 10−7 para H2, esta reacción procede en con un cambio de 2.2×10−12, más de 3 órdenes de magnitud más lentos que la reacción primaria anterior.
Algunas otras posibles reacciones de formación son:
H− + NH4+ → NH3 + H2 PNH3+ + e− → P + NH3
Mecanismos interestelares de destrucción
Hay 113 reacciones propuestas que llevan a la destrucción del NH3. De estas, 39 fueron tabuladas en extensas tablas de química junto con compuestos de carbono, nitrógeno y oxígeno. Una revisión del amoníaco interestelar cita las siguientes reacciones como los principales mecanismos de disociación:
(1) NH3 + H3+ → NH4+ + H2 (2) NH3 + HCO+ → NH4+ + CO
Con cambios constantes de 4.39×10−9 y 2.2×10−9, respectivamente. Las ecuaciones (1,2) corren con un cambio de 8.8×10−9 and 4.4×10−13, respectivamente. Estos cálculos asumen el cambio dado de constantes y abundancias de [NH3]/[H2] = 10−5, [H3+]/[H2] = 2×10−5, [HCO+]/[H2] = 2×10−9, y densidades totales de n = 105, típicas de frías y densas, nubes moleculares. Claramente, entre estas dos reacciones primarias, la ecuación (1) es la reacción dominante de destrucción, con un cambio de ~10,000 veces más rápido que la ecuación (2). Esto se debe a la relativa alta abundancia de H3+.
Detección de antenas individuales
Observaciones de radio de NH3 del Radiotelescopio de Effelsberg reveló que la línea de amoníaco está separada en dos componentes –un fondo rígido y núcleo sin forma–. El fondo corresponde bien con la localización previamente detectada de CO. El telescopio 25 m Chilbolton en Inglaterra detectó señales de radio de amoníaco en regiones H II, HNH2O, objetos H-H y otros objetos asociados con la formación de estrellas. Una comparación con la line de emisión indica que velocidades turbulentas o sistemáticas no incrementan en el centro del núcleo de las nubes moleculares.
La radiación de microondas del amoníaco fue observada en diversos objetos galácticos incluyendo W3 (OH), Orión (constelación), W43, W51, y cinco fuentes en el centro galáctico. La alta detección del cambio indica que es una molécula común en el medio interestelar y que las regiones de alta densidad son comunes en la galaxia.
Estudios Interferométricos
Observaciones VLA en siete regiones con flujos de alta velocidad gaseosos revelaron condensaciones de menos de 0.1 pc en L1551, S140 y Cefeo. Tres condensaciones individuales fueron detectadas en Cefeo, una de ellas era una figura muy alongada. Pueden jugar un rol importante en crear flojos bipolares en la región.
Amoníaco extragaláctico fue imaginado usando VLA en IC 342. La temperatura del gas caliente está arriba de los 70 K, lo cual fue inferido de las líneas del radio de amoníaco y parece estar asociadas con porciones más internas de la barra nuclear vista en CO. NH3 fue también monitoreada por VLA hacia la muestra de cuatro regiones galácticas ultracompactadas HII: G9.62+0.19, G10.47+0.03, G29.96−0.02, y G31.41+0.31. Basándose en diagnósticos de temperatura y densidad, se concluye que en general que tales cúmulos son probablemente los lugares de formación de estrella en una fase evolutiva temprana antes del desarrollo de una región HII ultracompacta.
Detecciones a infrarrojo
Absorciones a 2.91 micrómetros de amoníaco sólido fueron grabados de granos interestelares en el Objeto Becklin-Neugebauer y probablemente en NGC 2264-IR. Esta detección ayudó a explicar la forma física de las previamente pocas entendidas líneas de absorción de hielo.
Un espectro del anillo de Júpiter fue obtenido del observatorio Kuiper Airborne, cubriendo los 100 a 300 cm−1 del rango de espectro. Análisis del espectro provee información de propiedades globales de amoníaco en gas y la neblina de hielo de amoníaco.
Un total de 149 posiciones de nubes negras fueron revisadas para evidencia de "núcleos densos" usando la inversión de línea de (J,K) = (1,1) deNH3. En general, los núcleos no tienen figura de esfera, con radios rondando entre 1.1 a 4.4. También se encontró que núcleos con estrellas tienen líneas más amplias que núcleos sin estrellas.
El amoníaco se detectó también en Nébula de Draco y en un una o quizá dos nubes moleculares, que están asociadas con el cirrus infrarrojo.
Observaciones de Nubes Oscuras Cercanas
Balanceando y estimulando una emisión con una emisión espontánea, es posible construir una relación entre las temperaturas de excitación y la densidad. Más sin embargo, desde los niveles transitorios del amoníaco, se puede aproximar a un nivel 2 en un sistema de bajas temperaturas, este cálculo es sencillo. Esta premisa puede ser aplicada a nubes negras, regiones que se sospecha tienen extremadamente bajas temperaturas y posibles sitios para la futura formación de estrellas. Detecciones de amoníaco en nubes negras muestra líneas estrechas —indicando que no solo son bajas temperaturas, pero también un nivel bajo de turbulencia en la nube–. La línea de cálculos del radio provee una medida de la temperatura de la nube que es independiente de previas observaciones de CO. Las observaciones del amoníaco fueron consistentes con las medidas de CO de rotación de temperaturas de ~10 K. Con esto, las densidades pueden ser determinadas, y han sido calculadas en un rango de entre 104 y 105 cm−3 en nubes negras. Trazando el mapa de NH3, se concluye que tiene medidas cotidianas de las nubes de 0.1 pc y masas cercanas a una masa solas. Estos sitios fríos con núcleos densos son sitios donde se formará una estrella.
Regiones UC HII
Regiones HII ultra compactadas están entre los mejores trazadores de formación de estrellas de gran masa. EL material denso alrededor de regiones UCHII es primariamente molecular. Desde un completo estudio de formación de estrellas masivas, necesariamente involucra la nube de donde se formó la estrella, el amoníaco es una herramienta invaluable para comprender este material molecular que rodea. Puesto que este material molecular puede ser resuelto espacialmente, es posible constreñir los recursos de calor/ionizantes, temperaturas, masas y tamaño de las regiones. Los componentes de la velocidad Doppler desplazada permite la separación de distintas regiones de gas molecular que puede trazar flujos y núcleos calientes originados de la formación de estrellas.
Detección extragaláctica
El amoníaco ha sido detectado en galaxias externas, y por simultáneamente medir varías líneas, es posible directamente medir la temperatura del gas en estas galaxias. Las líneas del radio implican que las temperaturas son calientes (~ 50 K), originadas de nubes densas con tamaños de decenas de pc. Esta imagen es consistente con la imagen de nuestra Vía Láctea—núcleos moleculares densos y calientes se forman alrededor de estrellas que se están formando incrustadas en nubes con material molecular en la escala de varios cientos de pc (nubes moleculares gigantes).
Bibliografías
- Bailey, Philip S.; Bailey, Christina A. (1998). Química orgánica: conceptos y aplicaciones. Pearson Educación. ISBN 9789701701201.
- Bretherick, L., ed. (1986). Hazards in the Chemical Laboratory (4th edición). London: Royal Society of Chemistry. ISBN 0-85186-489-9. OCLC 16985764.
- Río, Rosario Solera del (2014). Aspectos biológicos de la digestión anaeróbica II.2. Ediciones Paraninfo, S.A. ISBN 9788484767008.
- Max Appl (2006). Ammonia, in Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH.
- Baker, H. B. (1894). J. Chem. Soc. 65: 612.
- Maurice P. Crosland (2004). Historical Studies in the Language of Chemistry. Courier Dover Publications. p. 72. ISBN 0-486-43802-3.
- Smith, Roland (2001). Conquering Chemistry. Sydney: McGraw-Hill. ISBN 0-07-470146-0.
- Tajkarimi, Mehrdad et al.; Riemann, H. P.; Hajmeer, M. N.; Gomez, E. L.; Razavilar, V.; Cliver, D. O. (2008). «Ammonia disinfection of animal feeds — Laboratory study». International Journal of Food Microbiology 122 (1-2): 23-28.
Fuentes
- Registro Estatal de Emisiones y Fuentes Contaminantes – España
- Sistema de Información Científica – Red de Revistas Científicas
- Agencia para Sustancias Tóxicas y el Registro de Enfermedades – Estados Unidos
- Instituto Internacional de Nutrición Vegetal
- ConceptoDefinición
- Laboratorio de Tecnología Química de la Universidad Politécnica de Madrid – España