Encefalopatía espongiforme familiar asociada a una nueva mutación en el gen de la proteina priónica
La encefalopatía espongiforme familiar asociada a nueva mutación en el gen de la proteina priónica (PrP) es una rarísima enfermedad neurológica priónica hereditaria asociada, como su nombre lo indica, a una nueva mutación en el gen PrP. Fue descubierta en 1996 en una única familia brasileña.
Un equipo formado por investigadores de las universidades de Londrina y San Pablo, Brasil y de la Universidad McGill de Montreal, Canadá (los doctores Ricardo Nitrini, Sergio Rosemberg, María Rita Passos-Bueno, Luís S. Teixeira da Silva, Paula Iughetti, María Papadopoulos, Paulo M. Carrilho, Paulo Caramelli, Steffen Albrecht, Mayana Zatz y Andrea LeBlanc) estudiaron a esta familia brasileña, muchos de cuyos miembros presentaban síntomas parecidos pero no idénticos a los de otras. Los científicos pudieron determinar que los pacientes padecían una nueva variedad desconocida hasta entonces de una encefalopatía espongiforme hereditaria, producto de una mutación nueva del gen PrP (mutación de novo).
La encelopatía espongiforme es una enfermedad degenerativa del cerebro, por suerte es rara y muy poco frecuente y se cree que se causa por una proteína que se convierte en una forma anormal llamada prión. En la enfermedad por priones, una molécula proteica específica llamada proteína prión celular PrP cambia de forma y se convierte en una molécula proteica anormal denominada proteína prión scrapie. Esta enfermedad por priones puede afectar a una familia debido a factores hereditarios. Pueden darse diferentes tipos de mutaciones en esta enfermedad.
Sumario
Los priones y su bilogía.
Prion: Proteinaceous infectious particles.
Los priones son los agentes causantes de un grupo de patologías neurodegenerativas letales características de mamíferos, también conocidas como encefalopatías espongiformes transmisibles.
La búsqueda de la entidad molecular constitutiva de este agente reveló como componente mayoritario, si no único, una proteína: PrPSc, proteína del prion de scrapie, y la ausencia de un ácido nucleico específico (Prusiner 1982, 1991).
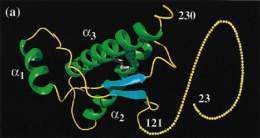
Se denomina prion a la forma alterada de una proteína celular funcional (PrPC en mamíferos) que ha podido perder su función normal pero que ha adquirido la capacidad de transformar la forma normal en patológica.
En humanos, la enfermedad se manifiesta como demencia progresiva, mientras que en animales suele manifestarse como ataxias.
Como los virus, los priones pueden perpetuarse y multiplicarse causando enfermedad, pero al contrario que aquellos, los priones NO SON INMUNOGÉNICOS.
Los niveles más altos de PrPC se encuentran en cerebro, particularmente en el hipocampo, existiendo niveles significativos en corazón y músculo esquelético y, más bajos, en la mayoría de los órganos restantes excepto en hígado y en páncreas (Prusiner,1997).
En las patologías de priones, PrPC se transforma post-traduccionalmente en una isoforma generalmente denominada PrPSc (Prusiner [[1991, 1997).
Aunque pueden presentar muchas isoformas, extracción con detergentes de fracciones de membranas de cerebros infectados generan unas varillas de unos 11 nm de diámetro y hasta 165 nm de longitud (de media: rango 25-550).
Los priones resisten intentos de inactivación por nucleasas, UV, agentes queladores, variación de pH, proteasas… Pero sí baja la infectividad con urea, hervir en SDS o autoclave a 132ºC durante más de 2 horas-PrPC es sensible a la acción de proteasas y PrPSc, por el contrario, sufre una proteolisis limitada generando la forma truncada en el extremo N-terminal que agrega en forma de amiloides y retiene la infectividad. (Prusiner, 1991; Ghetti y cols., 1996).
El prion se une a la proteína PrPC produciendo nuevos priones por cambio de conformación. Al parecer se necesita una proteína-X celular para inducir dicho cambio.
El mecanismo mediante el cual se propagan los priones no se conoce con precisión. Aunque algunos investigadores siguen postulando la necesidad de un ácido [[nucleico específico de priones, no existen evidencias físicas ni químicas de su existencia. En el caso de existir, cabe esperar que dicha molécula dirija la replicación de priones empleando una estrategia similar a la de los virus.
El proceso de propagación de un prion se inicia con la interacción de la PrPSc exógena con PrPC o con una forma parcialmente desnaturalizada de ésta, PrP* (Scott y cols., 1989; Kocisko y cols., 1994). El reconocimiento de PrPSc ocurre a través de la región 96-167 Aa, siendo necesaria pero insuficiente la identidad de secuencia.
La infección ocurre a través de un complejo PrPC-PrPSc, cuya formación está gobernada por el grado de identidad de secuencia entre la proteína endógena y la exógena (Scott y cols., 1989; 1993).
Entre las enfermedades priónicas humanas se incluyen la enfermedad de Creutzfeld-Jakob (CJD), la enfermedad de Gerstmann-Straussler-Scheinker (GSS), el Insomnio Familiar Fatal (FFI) y el Kuru. Sin embargo, en los últimos años se han descrito una variedad de cuadros clínicos de etiopatogenia priónica que han ampliado el espectro clínico de estas enfermedades: demencia por prion sin patología característica, demencia con paraparesia espástica, demencia talámica, Encefalopatía espongiforme familiar asociada a nueva mutación en el gen PrP, Gliosis subcortical progresiva, enfermedad mental sin signos neurológicos. Asimismo, casos descritos como enfermedad de Alzheimer familiares han sido reexplorados y catalogados de origen priónico.
Genética de las encefalopatías espongiformes transmisibles
Se estima que cerca del 15% de los casos de enfermedades por priones en humanos se heredan de forma autosómica dominante. Todos los hallazgos indican que el aminoácido situado en la posición 129 tiene una función esencial en las interacciones PrPSc-PrPC , en la conformación de la PrP y en el tipo de enfermedad que se desarrollará.
En la ECJ clásica se han descrito 7 mutaciones puntuales diferentes (por ejemplo, Val à Ile) y 5 tipos de delecciones/inserciones distintas del gen PRNP. En GSS se han descrito 6 mutaciones puntuales diferentes (por ejemplo, Ala à Val) y 2 tipos de delecciones/inserciones distintas del gen PRNP. En el IF se ha descrito la mutación puntual Asp àAsn del mismo gen.
La existencia de polimorfismo en el codon 129 del gen PRNP parece que actúa como un factor de susceptibilidad genética. En esa posición se codifica Metionina (Met) o Valina (Val). En la población caucásica, la distribución de genotipos es: 37% Met/Met, 51% Met/Val, y 12% Val/Val, es decir, un 50% aproximadamente es homocigoto para Met o Val y un 50% heterocigoto. En algunos estudios sobre la ECJ clásica esporádica y ECJ iatrogénica por hormona del crecimiento contaminada, la prevalencia de homocigotos para Met o Val en el codon 129 es de un 90%, lo que sugiere que la homocigosidad en el codon 129 es un factor de riesgo para esta enfermedad por priones. Por otro lado, en todos los casos conocidos de vECJ los genotipos de los enfermos son homocigotos para Met.
El genotipo en el codon 129 también afecta al curso de la enfermedad. De esta forma, los enfermos de ECJ clásica esporádica homocigotos para Met se asocian generalmente a una enfermedad demenciante rápidamente progresiva, mientras que el genotipo Val/Val se asocia a un curso más prolongado con aparición de ataxia.
Por otro lado, en algunas formas familiares de la enfermedad, la homocigosidad en el codon 129 se asocia con una menor edad de aparición y un curso más agresivo de la enfermedad.
La frecuencia de distribución de genotipos varía con las razas, así, mientras que entre los caucásicos la proporción es Met (0.66):Val (0.34), las frecuencias alélicas en descritas en Japón son Met(0.96): Val(0.04). La incidencia de ECJ en Japón no es mayor que en el resto del mundo, por lo que la homocigosidad en el codon 129 no predice un mayor riesgo de enfermedad, pero predispone a un individuo a padecer el fenotipo clínico de ECJ si se suman otros factores de riesgo esenciales.
Los portadores de mutaciones puntuales (como PRNP-E200K) muestran un mayor riesgo de desarrollar la enfermedad conforme avanza la edad de los pacientes. La mutación más frecuente en la ECJ en todo el mundo es la sustitución de glutamato (E) por lisina (K) en el codon 200: E200K (Glu à Lys). También son frecuentemente observadas las siguientes mutaciones: D178N (Asp à Asn en ECJ, ó Asp àAsn en IF), y la inserción de 144-bp. La mutación más frecuente en GSS es P102L (Pro àLeu).
En todos los pacientes de vECJ el codon polimórfico 129 es homocigoto para Met, sugiriendo que la homocigosidad para Met incrementa la susceptibilidad a vECJ. Otra posibilidad es que los pacientes con genotipo homocigoto para Val no desarrollan la patología característica descrita en la vECJ.
Transmisión de EET en humanos.
La naturaleza transmisible de las enfermedades por priones fue demostrada por primera vez experimentalmente en 1936, cuando Cuillé y Chelle transmitieron scrapie a una cabra sana mediante la administración intraocular de médula espinal infectada de scrapie. Treinta años más tarde, Gajdusek y cols (1966) consiguieron transmitir kuru a chimpancés.
En 1968 Gibbs y cols. transmitieron la ECJ esporádica a chimpancés. En la década de 1960, Carleton Gajdusek confirmó que la enfermedad de Creutzfeldt-Jakob era transmisible. A pesar de haber transcurrido más de tres décadas desde que se comenzó la investigación de la transmisión de enfermedades por priones, la información hoy día disponible se puede definir como fragmentada y e incoherente.
Incluso antes de conocerse la relación entre la vECJ y el "mal de las vacas locas", se sabía que existía una enfermedad de Creutzfeldt-Jakob (llamada iatrogénica) que podía ser transmitida por la administración de la hormona de crecimiento humana y la hormona gonadotropina procedentes de cadáveres, o mediante trasplantes de córnea o de duramadre.
En las enfermedades priónicas en humanos, la mayoría de los casos son esporádicos (son casos generalmente de Enfermedad de Creutzfeld-Jakob), pero también es importante la transmisión familiar o genética (en la Enfermedad de Creutzfeld-Jakob, la enfermedad de Gerstmann-Straussler-Scheinker, el Insomnio Familiar Fatal y la Demencia Talámica). Otras vías de transmisión son la iatrogénica (descrita anteriormente) y, en la enfermedad del kuru por ingesta, en relación con rituales de canibalismo en tribus Fore en Papua, [[Nueva Guinea.
Ciertas circunstancias en el Reino Unido causaron la aparición y propagación de la EEB en el ganado, entre estas circunstancias se encuentran, por una parte, el empleo frecuente de carne y huesos en piensos que procedían de ovejas infectadas de scrapie y por otra, la adopción de un nuevo tipo de procesamiento que no reducía la cantidad de priones infecciosos tras la elaboración del pienso.
La EEB también ha sido transmitida a rumiantes salvajes en zoológicos del Reino Unido, que fueron infectados al comer los mismos piensos concentrados de carne y huesos contaminados, responsables de la enfermedad en el ganado [[bovino. También se ha descrito la encefalopatía espongiforme en más de 80 gatos y en algunos felinos de zoológicos británicos.
Hoy en día los estudios se están centrando en probar la ingesta como un factor de riesgo real.
Experimentalmente, se ha confirmado que la encefalopatía espongiforme bovina puede ser transmitida por vía oral e intracerebral a diferentes especies animales (incluyendo primates) con mayor o menor facilidad, aunque, sobre todo, es posible pasarla por vía oral de una vaca a otra con apenas la ingestión de pequeñas cantidades de cerebro(). El patrón de la EEB se mantiene a pesar de su paso a un número variable de animales intermedios. Esta firma del prión de la EEB también había sido identificada en animales exóticos y gatos domésticos infectados con la EEB. La firma de la EEB presentaba una gran homogeneidad en su comportamiento y una gran ubicuidad para infectar diversas especies de animales, este hecho no se había visto antes con otros agentes priónicos desde 1963.
La transmisión de ECJ esporádica a primates humanos se consigue en un 85% de los casos. La inoculación a ratones transgénicos que expresan la PrP humana es aún más eficaz, consiguiéndose en casi un 100% de los casos. Esta mejor transmisión en ratones transgénicos que expresan la PrPC humana demuestra la importancia de la homología de secuencia entre PrPSc y PrPC y ayuda a explicar la dificultad en la transmisión entre especies con secuencia PrP distintas, un hecho conocido como "barrera de las especies". Sin embargo, la aparición de la vECJ y la transmisión de priones humanos a ratones transgénicos que expresan PrPC bovino hacen pensar que la secuencia de PrP no es el único factor importante para la transmisión de la enfermedad. El factor determinante puede ser la capacidad de PrPC para adoptar la conformación de PrPSc, la cual debe estar influida tanto por la secuencia de la proteína como por otros factores (ej. proteínas carabina).
El grado de transmisión de GSS a primates no humanos es bajo (40%), comparado con la ECJ. Además, los intentos de transmitir GSS a roedores no han tenido éxito. La escasa capacidad de transmisión de esta enfermedad podría estar relacionada con la escasez relativa de PrP proteasa resistente en el cerebro de los pacientes.
Hasta la fecha, la Unidad de Vigilancia de la ECJ del Reino Unido no ha detectado ningún caso de vECJ consecuencia de procedimientos quirúrgicos o médicos.
Diagnóstico
Al igual que las demás enfermedades priónicas, solo puede diagnosticarse in vivo mediante la biopsia cerebral. Dado que este procedimiento es sumamente cruento, que es muy factible que se tome muestra de una parte del encéfalo no afectada, y que el correcto diagnóstico no mejora el pronóstico ni amplía las probabilidades de sobrevida del paciente, habitualmente, como en el caso de la ECJ, se prefiere evitarlo y limitarse al diagnóstico post-mortem (autopsia).
Prevalencia
Dado que la patología solo ha sido diagnosticada en una familia de un único país, se estima que la prevalencia es bajísima (inferior a 1:10.000.000). No se conocen nuevos casos.
Presentación clínica
Esta encefalopatía se diferencia de otras —como la enfermedad de Creutzfeldt-Jakob— por su más temprana aparición de los síntomas y una mayor duración de los mismos antes de que sobrevenga la muerte.
El síntoma principal es la demencia, que se presenta entre la cuarta y quinta década de la vida (en promedio, a los 44,8 años de edad), con una duración entre 2 y 9 años (promedio: 4,2 ± 2,4 años).
La demencia se presenta acompañada de cambios radicales de la personalidad y defectos de la memoria, y frecuentemente de síndrome parkinsoniano.
El caso más benigno estaba totalmente inválido a los 5 años de evolución, y en la etapa terminal presentaba mioclono sin actividad electroencefalográfica periódica.
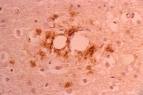
Tres de los pacientes mostraban destrucción neuronal extensa en las capas corticales profundas y en el putamen, con grandes cambios de tipo espongiforme y gliosis mínima en las áreas más afectadas.
Nueve de los enfermos presentaba claros signos de demencia frontotemporal. El análisis del putamen y el cerebelo mostró inmunorreactividad a la proteína priónica. La substitución no conservativa en el codón 183 fue confirmada en dos de los pacientes afectados —una madre y su hijo—. La enfermedad fue heredada por otros doce miembros de la misma familia.
Tratamiento
No existe curación para esta enfermedad por priones y en todos los casos es mortal. El tratamiento médico esta enfocado a mantener en mejor estado a la persona y tratar los síntomas, (por ejemplo con anticonvulsivos). Los familiares de las personas en las que se manifiesta la forma hereditaria de la enfermedad deben pedir consejo genético.
El consejo genético es un aspecto fundamental en el manejo de la enfermedad por prión familiar. Aunque es discutible si las pruebas genéticas deben realizarse en los miembros asintomáticos de la familia, la administración Norteamericana ha prohibido la donación de sangre a los familiares de pacientes con enfermedades por priones, a menos que el análisis genético del donante potencial demuestre una secuencia normal del gen PRNP.
Perspectivas de futuro
A la vez que se aclaran los mecanismos íntimos de transmisión de estas enfermedades priónicas, pronto asistiremos a técnicas de diagnóstico más precoces, tanto de mediante exámenes en líquidos corporales, como técnicas radiológicas. Estas técnicas complementan a la electroencefalografía (EEG), que hoy en día es un importante elemento de ayuda en el diagnóstico de probabilidad de la enfermedad de Creutzfeldt-Jakob.
Se desconoce si en un futuro más o menos próximo existirá una epidemia de vECJ, pero conviene destacar que la incidencia de nuevos casos en el Reino Unido ha permanecido baja durante estos años.
Sir John Pattison, miembro del Comité Consultivo para Encefalopatías Espongiforme del Reino Unido, describía así en 1998 el futuro sobre este tema:
"Muchas cosas han sucedido ya como consecuencia de la aparición de la EEB en el ganado del Reino Unido. Las medidas adecuadas ya han sido tomadas para proteger la salud pública y poner fin a la epidemia de EEB en el ganado vacuno y en otras especies afectadas. Estas medidas son más rigurosas que nunca. Es difícil adivinar qué podría haberse hecho para hacer que la epidemia de EEB disminuyera aún más rápidamente de lo que ha decrecido, aparte de eliminar toda la cabaña británica, que hubiese sido innecesario y poco práctico. A partir de ahora la pregunta seguramente será cómo retirar algunas de las restricciones impuesta a la carne de vaca y a los productos de vacuno. Las exenciones probablemente se basarán en determinadas explotaciones (como ha sido el caso de Irlanda del Norte) o basadas en fechas tras la prohibición total de 1996 sobre el uso de carne y huesos en la alimentación de cualquier animal de granja en el Reino Unido. En términos de protección de la salud pública, todas las medidas necesarias han sido instauradas. Aún persisten dos motivos de preocupación: si la EEB existe o no en los rebaños de ovejas y si el número de casos de vECJ en el Reino Unido será suficientemente alto como para generar preocupación por una segunda oleada de transmisiones dentro de la población humana como consecuencia del uso de sangre y derivados sanguíneos. Con respecto a lo primero, en el Reino Unido se ha intensificado la detección de ovejas con enfermedades similares al scrapie y la tipificación de tipos de priones en los animales afectados. Con respecto a la sangre y derivados sanguíneos, en el Reino Unido ya se han tomado algunas medidas relativas al uso de productos sanguíneos, y se está valorando detalladamente el riesgo en relación con la transfusión sanguínea".'
La presencia de depósitos de placas amiloides de PrP en ciertos casos de gliosis subcortical progresiva ha movido a algunos científicos a sugerir que al menos algunas de las formas clínicas de esta última enfermedad sean priónicas. Sin embargo, estudios autocríticos de estas hipótesis exigen que se esperen los resultados de nuevos estudios e investigaciones.
Resumen
Las Encefalopatías Espongiformes Transmisibles (EET) son enfermedades raras, con periodos de incubación largos (meses a años), que afectan al sistema nervioso central y progresan lentamente hasta la muerte del enfermo. En los animales, la EET más conocida actualmente es la encefalopatía espongiforme bovina (EEB) o "mal de las vacas locas". En el ser humano de conocen este tipo de enfermedades desde hace más de 80 años y dan lugar a cuadros clínicos conocidos como enfermedad de Creutzfeldt-Jakob, kuru, insomnio fatal, etc. A pesar de su rareza en el ser humano, las enfermedades por priones han adquirido una importancia social elevada debido, por una parte, a la posible conexión entre una nueva variante de enfermedad de Creutzfeldt-Jakob (vECJ) que se describió en 1995 en humanos y la encefalopatía espongiforme bovina. En las EET hay bastantes evidencias a favor de que el agente causal sea una proteína resistente a proteasas (prión) y no un virus, que sorprendentemente existe normalmente en el huésped, con una estructura algo distinta ("prión sano"), aunque hay evidencias que indican que otras proteínas (Dpl o doppel) también podría participar en la patogenia de estas enfermedades.
Hasta el momento, se han declarado 182.507 reses enfermas de EEB en todo el mundo, la mayoría (179.441) en el Reino Unido, y se han confirmado 13 casos en España. Por otra parte, se han observado 91 pacientes afectados de vECJ, principalmente en el Reino Unido. La importancia de la aparición de la vECJ es que el agente causal ha sido capaz de saltar la llamada "barrera de las especies". Aunque experimentalmente se ha transmitido en animales, no hay evidencias directas de transmisión de vECJ a través de transfusión sanguínea o vacunas en humanos. Desconocemos el número de casos de vECJ que aparecerán en los próximo años, pero conviene destacar que la incidencia de nuevos casos en el Reino Unido ha permanecido baja durante estos años.
Véase también
Enlaces externos
- Clínica de las enfermedades priónicas humanas, Universidad de Elche
- Destructores de cerebros: los priones, por Marcelo Dos Santos, Axxón
Fuentes
- http://svneurologia.org/congreso/priones-5.html
- http://www.quierosaberquetengo.com/dinamica/index.php?view=article&catid=35%3Araras&id=125%3Aencefalopatia-espongiforme-familiar-asociada-a-una-nueva-mutacion-en-el-gen-prp&option=com_content
- http://dime2.com/enfermedades-raras/334-encefalopatia-espongiforme-familiar-asociada-nueva-mutacion-gen-prp.html
- http://www.aecientificos.es/empresas/aecientificos/intereshtml/mal_vacas/encefalopatias_espongiformes.html
- http://www2.cbm.uam.es/jalopez/personal/seminariosvarios/Priones.htm
- http://www.slideshare.net/guest90086be/prioneshttp://www.buenastareas.com/ensayos/Priones/2513751.html
- http://books.google.com.cu/books?id=Wv026CUhR6YC&pg=PA612&lpg=PA612&dq=Encefalopat%C3%ADa+espongiforme+familiar+asociada+a+una+nueva+mutaci%C3%B3n+en+el+gen+PrP&source=bl&ots=n4pyrCtIN8&sig=2Pqdctmy8FqqI2bj_cG5acnf_hM&hl=es&sa=X&ei=DxNET5uoBOf40gGtuuWvBw&redir_esc=y#v=onepage&q=Encefalopat%C3%ADa%20espongiforme%20familiar%20asociada%20a%20una%20nueva%20mutaci%C3%B3n%20en%20el%20gen%20PrP&f=false