Celda electrolítica
| ||||
Celda electrolítica. Es capaz de comportarse como una pila galvánica. Cuando los dos electrodos son conectados por un hilo, es producida energía eléctrica, y tiene lugar un flujo espontáneo de electrones desde el electrodo del cinc al electrodo del cobre. La misma celda también puede ser manejada como una celda electrolítica. Para esto sería necesario introducir en el circuito externo una batería que forzara a los electrones a fluir en la dirección opuesta a través de la celda. Bajo estas circunstancias, el cinc se depositaría y el cobre se disolvería; estos procesos consumirían energía de la batería.
Sumario
Tipos
Hay dos tipos fundamentales de celdas y en ambas tiene lugar una reacción redox, y la conversión o transformación de un tipo de energía en otra:
Cuba electrolítica, mostrando los electrodos y la fuente de alimentación que genera la corriente eléctrica.
- La celda voltaica transforma una reacción química espontánea en una corriente eléctrica, como las pilas y baterías. También reciben los nombres de celda galvánica, pila galvánica o pila voltaica. Son muy empleadas por lo que la mayoría de los ejemplos e imágenes de este artículo están referidos a ellas.
- La celda electrolítica transforma una corriente eléctrica en una reacción química de oxidación-reducción que no tiene lugar de modo espontáneo. En muchas de estas reacciones se descompone una sustancia química por lo que dicho proceso recibe el nombre de electrolisis. También reciben los nombres de celda electrolítica o cuba electrolítica. A diferencia de la celda voltaica, en la célula electrolítica, los dos electrodos no necesitan estar separados, por lo que hay un sólo recipiente en el que tienen lugar las dos semirreacciones.
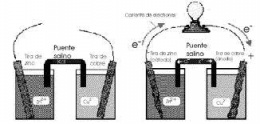
Las semiceldas o semireacciones en una celda voltaica
Una celda galvánica o celda voltaica consta de dos semiceldas conectadas eléctricamente mediante un conductor metálico, y también mediante un puente salino. Cada semicelda consta de un electrodo y un electrolito. Las dos semiceldas pueden utilizar el mismo electrolito, o pueden utilizar electrolitos diferentes. Las reacciones químicas en la celda pueden implicar al electrolito, a los electrodos o a una sustancia externa (como en las pilas de combustible que puede utilizar el hidrógeno gaseoso como reactivo).
En una celda voltaica completa, las especies químicas de una semicelda pierden electrones (oxidación) hacia su electrodo mientras que las especies de la otra semicelda ganan electrones (reducción) desde su electrodo. Un puente salino se emplea a menudo para proporcionar un contacto iónico entre las dos medias celdas con electrolitos diferentes, para evitar que las soluciones se mezclen y provoquen reacciones colaterales no deseadas.
Este puente salino puede ser simplemente una tira de papel de filtro empapado en solución saturada de nitrato de potasio. Otros dispositivos para lograr la separación de las disoluciones son vasijas porosas y disoluciones gelificadas. Un recipiente poroso se utiliza en la pila de Bunsen (derecha).
También se les denomina semirreacciones pues en cada una de ella tiene lugar una parte de la reacción redox:
- La pérdida de electrones (oxidación) tiene lugar en el ánodo.
- La ganancia de electrones (reducción) en el cátodo.
Reacción de equilibrio
Cada semicelda tiene una tensión característica llamada potencial de semicelda o potencial de reducción. Las diferentes sustancias que pueden ser escogidas para cada semicelda dan lugar a distintas diferencias de potencial de la celda completa, que es el parámetro que puede ser medido. No se puede medir el potencial de cada semicelda, sino la diferencia entres los potenciales de ambas.
Cada reacción está experimentando una reacción de equilibrio entre los diferentes estados de oxidación de los iones; cuando se alcanza el equilibrio, la célula no puede proporcionar más tensión. En la semicelda que está sufriendo la oxidación, cuanto más cerca del equilibrio se encuentra el ion/átomo con el estado de oxidación más positivo, tanto más potencial va a dar esta reacción. Del mismo modo, en la reacción de reducción, cuanto más lejos del equilibrio se encuentra el ion/átomo con el estado de oxidación más negativo, más alto es el potencial.
Potenciales de electrodo y fuerza electromotriz de una pila
El potencial o fuerza electromotriz de una pila se puede predecir a través de la utilización de los potenciales de electrodo, las tensiones de cada semicelda. (Ver tabla de potenciales de electrodo estándar). La diferencia de voltaje entre los potenciales de reducción de cada electrodo da una predicción para el potencial medido de la pila.
Los potenciales de pila tienen un rango posible desde 0 hasta 6 voltios. Las pilas que usan electrolitos disueltos en agua generalmente tienen potenciales de celda menores de 2,5 voltios, ya que los oxidantes y reductores muy potentes, que se requerirían para producir un mayor potencial, tienden a reaccionar con el agua.
Tipos de celdas galvánicas
Principales tipos
Las celdas o células galvánicas se clasifican en dos grandes categorías:
- Las células primarias transforman la energía química en energía eléctrica, de manera irreversible (dentro de los límites de la práctica). Cuando se agota la cantidad inicial de reactivos presentes en la pila, la energía no puede ser fácilmente restaurada o devuelta a la celda electroquímica por medios eléctricos
- Las células secundarias pueden ser recargadas, es decir, que pueden revertir sus reacciones químicas mediante el suministro de energía eléctrica a la celda, hasta el restablecimiento de su composición original.
Celdas galvánicas primarias
Las celdas galvánicas primarias pueden producir corriente inmediatamente después de su conexión. Las pilas desechables están destinadas a ser utilizadas una sola vez y son desechadas posteriormente. Las pilas desechables no pueden ser recargadas de forma fiable, ya que las reacciones químicas no son fácilmente reversibles y los materiales activos no pueden volver a su forma original. Generalmente, tienen densidades de energía más altas que las pilas recargables, pero las células desechables no van bien en aplicaciones de alto drenaje con cargas menores de 75 ohmios (75 Ω).
Celdas galvánicas secundarias
Las celdas galvánicas secundarias deben ser cargadas antes de su uso; por lo general son ensambladas con materiales y objetos activos en el estado de baja energía (descarga). Las celdas galvánicas recargables o pilas galvánicas secundarias se pueden regenerar (coloquialmente, recargar) mediante la aplicación de una corriente eléctrica, que invierte la reacciones químicas que se producen durante su uso. Los dispositivos para el suministro adecuado de tales corrientes que regeneran las sustancias activas que contienen la pila o batería se llaman, de modo inapropiado, cargadores o recargadores.
La forma más antigua de pila recargable es la batería de plomo-ácido. Esta celda electroquímica es notable, ya que contiene un líquido ácido en un recipiente sellado, lo cual requiere que la celda se mantenga en posición vertical y la zona de estar bien ventilada para garantizar la seguridad de la dispersión del gas hidrógeno producido por estas células durante la sobrecarga. La celda de plomo-ácido es también muy pesada para la cantidad de energía eléctrica que puede suministrar. A pesar de ello, su bajo costo de fabricación y sus niveles de corriente de gran aumento hacen que su utilización sea común cuando se requiere una gran capacidad (más de 10A·h) o cuando no importan el peso y la escasa facilidad de manejo.