Diagrama de Frost
| ||||||
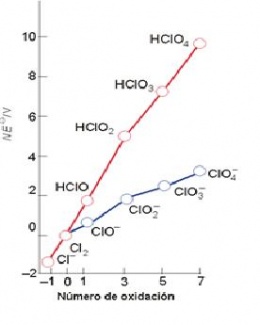
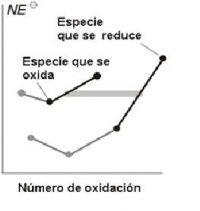
El Diagrama de Frost, es una representación de la energía libre estándar de formación frente al número de oxidación. De esta forma el estado de oxidación más estable corresponde a la especie situada más abajo en el diagrama de Frost.
Sumario
Descripción
Un diagrama de Frost para un elemento X, consiste en la representación de nE° para un par X(N)/X(0) frente al número de oxidación, N, del elemento. Como nE° es proporcional a la energía libre estándar de la reacción de conversión de la especie X(n) a X(0).
Construcción de un diagrama de Frost
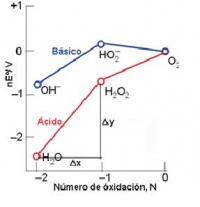
Diagrama de Frost para el oxígeno, a partir del diagrama de Latimer, en medio ácido
Para el cambio de O2 a H2O2, del número de oxidación 0 a -1, n= -1 y por lo tanto, nE°= - 0.70V. Para el cambio de O2 a H2O, de 0 a -2, n=-2, y por lo tanto, nE°= -2x1.23 0 -2.46V. La pendiente de la línea que une dos puntos cualesquiera en un diagrama de Frost es igual al potencial normal del par formado por las dos especies que representan los dos puntos. Por ejemplo, en el punto correspondiente al estado de oxidación -1 para el diagrama de Frost, en medio ácido, nE°= - 0.70, y en el estado de oxidación nE°= - 2.46, luego la diferencia Dy es de - 1.76. La variación del número de oxidación al pasar de H2O a H2O2 es de Dn= -1 (Dx), por lo tanto m= Dy/Dx = (- 1.76/-1) = 1.76V que concuerda con el valor de E° del par H2O2/ H2O en el diagrama de Latimer.
La mayor aplicación de los diagramas de Frost radica en la impresión rápida cualitativa que permite predecir las tendencias de las propiedades químicas de las distintas especies. Para interpretar las informaciones cualitativas contenidas en un diagrama de Frost, se deben tener en cuenta los siguientes aspectos:
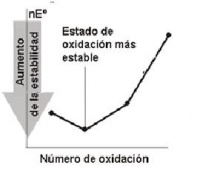
- La especie más estable se encuentra más abajo en el diagrama de Frost
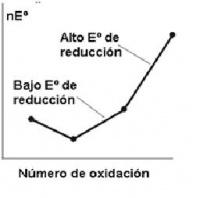
- Cuanto más inclinada sea la línea que une a dos puntos del diagrama mayor, será el potencial del par. Por ello se puede deducir la espontaneidad de la reacción entre dos pares cualesquiera comparando las líneas correspondientes. Se tendrá que el agente oxidante (especie oxidada) del par con pendiente más positiva (mayor valor de E0) se reducirá y el agente reductor (especie reducida) del par con pendiente menos positiva (menor valor de E0) se oxidará.
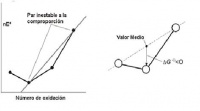
- En un diagrama de Frost, se puede deducir que un ión o molécula es inestable con respecto a su desproporción si se encuentra por encima de la línea que une dos especies contiguas. La energía DG0 de la especie intermedia está por encima del valor medio de las dos especies terminales, lo que significa que es inestable frente a su desproporción.
- Dos especies tienden a comproporcionarse en una especie intermedia si se encuentra por debajo de la línea de unión que las une.
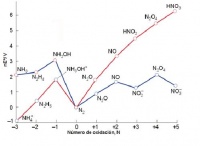
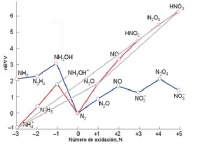
La energía libre de esta especie es más baja que el valor medio de las otras dos. === Ejemplo ===: El NH4NO3 se compone de dos iones en los cuales el nitrógeno presenta distinto número de oxidación: - 3 (NH4+) y +5 (NO3-). Como en el N2O el átomo de nitrógeno posee un número de oxidación medio a los anteriores (+ 1) y se observa que está por debajo de la línea del NH4+ y NO3-, su comproporción está permitida por la termodinámica.
La reacción está cinéticamente inhibida en disolución diluida, y no se produce normalmente. Sin embargo, en estado sólido es tan rápida, que pueden incluso producirse explosiones. De hecho, el NH4NO3 se usa con frecuencia en lugar de la dinamita para explosionar rocas.