Efecto inductivo (Química)
| ||||
Efecto inductivo. Es el que prevalece en el estado normal de la molécula. Es un fenómeno asociado esencialmente a los enlaces covalentes simples. El par electrónico que es el enlace normal covalente, se desplaza ligeramente cuando en la molécula existe un átomo que ejerza sobre el par electrónico una atracción mayor o menor que el resto de los átomos.
Características del efecto
Cuando dos átomos de distintos elementos se enlazan químicamente mediante un enlace sigma, los electrones se desplazarán ligeramente hacia el átomo que tenga mayor electronegatividad.
Como consecuencia se forman dipolos, en el entorno del átomo que atrae electrones la carga será negativa (δ-), y en los alrededores del otro, la carga será positiva (δ+).
Conceptos
Si el átomo más electronegativo se une a una cadena de carbonos, por ejemplo, la carga positiva es inducida en los átomos que forman esta cadena. A este fenómeno se le llama efecto inductivo estático. El efecto de inducción de cargas también puede ser ejercido por un medio polar, en este caso el fenómeno se denomina efecto inductivo dinámico.
El efecto que ejercen los átomos más electronegativos que el hidrógeno, que es el de atraer electrones hacia sí e inducir carga positiva en el resto de los átomos, es también conocido como efecto inductivo aceptor o -I. Ejemplos de átomos o grupos con efecto inductivo negativo son:
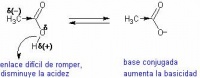
El efecto contrario, causado por átomos o grupos menos electronegativos que el hidrógeno, es denominado efecto inductivo dador o +I. Un ejemplo de este tipo de efecto inductivo (positivo) es por ejemplo el causado por grupos alquilo, metilo, entre otros.
Los grupos con tendencia a donar electrones, ayudan a disminuir la acidez y aumentar la basicidad de la molécula. Por el contrario, los átomos más electronegativos, aceptores de electrones, polarizan en enlace y aumentan la acidez de la molécula, dado que los átomos de hidrógeno unidos al mismo quedan con carga parcial positiva y el enlace se debilita.
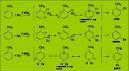
Ejemplos de efectos inductivos
Ejemplos de ácidos carboxílicos, su pKa (logaritmo negativo de su constante de disociación) y efectos inductivos observados:
Por ejemplo, al efecto inductivo que interviene en la liberación de electrones del grupo metilo, se le debe la estabilidad de los carbocationes en la secuencia terciario secundario primario metilo.
Por efecto inductivo del grupo metilo, aumenta la basicidad de la molécula, aumenta su pKa, es decir, se disocia menos. pKa de 4,76.
En este caso, el flúor es un átomo con electonegatividad alta, aumenta la acidez de la molécula por efecto inductivo negativo, el pKa es bajo, 2,66.
La presencia de dos átomos de cloro, con electronegatividad elevada, hace que la molécula aumente su tendencia a disociarse, es decir, aumente su acidez. Pka 1,29.
Cuando agregamos un átomo más de cloro, el pKa desciende mucho, aumentando la acidez. Pka 0,05.
La acumulación de cargas negativas sobre un mismo átomo de carbono hace que disminuya la tendencia de disociación de la molécula, aumenta su basicidad. pKa de 5,65.
En la figura que sigue, observa el efecto del sustituyente cloro, que causa un efecto inductivo negativo en el ácido butanoico, pero podemos observar cómo éste efecto disminuye a medida que el cloro se aleja del centro activo., es decir, a medida que el sustituyente se ubica en un carbono más alejado del grupo ácido.
- . Acido butanoico: pKa = 8.9×10-5
- . Acido 2 cloro butanoico pKa = 1.39×10-5
- . Acido 3 cloro butanoico pKa = 1.52×10-5
- . Acido 4 cloro butanoico pKa = 2.96×10-5
Fuentes
- . Manual de Química Inorgánica y Analítica. Editorial Félix Varela. La Habana, Cuba