Estructura cristalina de los metales
| ||||||
Estructura cristalina de los metales. Toda sustancia puede encontrarse en tres estados de agregación: Sólido, líquido y gaseoso. Aunque se menciona en varias bibliografías un cuarto estado: plasma donde se requieren altas temperaturas (de decenas de miles de grados), donde la sustancia gaseosa pasa a estado plasma que se caracteriza por el desarrollo del proceso de ionización, hasta llegar a la destrucción total de la capa electrónica de los átomos.
La sustancia sólida sometida a la acción de las fuerzas de la gravedad conserva su forma, mientras que la líquida se extiende y toma la forma del recipiente que la contiene. Esta definición es insuficiente para caracterizar el estado de la sustancia.
Así por ejemplo, el vidrio sólido, si se calienta, va ablandándose y pasa poco a poco al estado líquido. La transición inversa también será completamente suave; el vidrio líquido, a medida que se baja la temperatura se va haciendo cada vez más espeso hasta que finalmente se solidifica. En el vidrio no existe una temperatura determinada de transición del estado líquido a sólido, tampoco existen temperaturas o puntos de cambio brusco de sus propiedades. Por esto es normal considerar el vidrio "sólido" como un líquido sumamente espeso
Sumario
Comparación entre los 3 estados de agregación en los metales
En los gases no existe una distribución regular de las partículas (átomos y moléculas) ; sus partículas se mueven caóticamente , chocan unas con otras y el gas tiende a ocupar el mayor volumen posible.
En los sólidos existe un orden determinado, regular, de distribución de los átomos, las fuerzas de atracción y repulsión mutua están en equilibrio y el sólido conserva su forma.
En los líquidos las partículas conservan únicamente el llamado orden próximo, es decir, en el espacio está distribuida regularmente una cantidad pequeña de átomos, y no los átomos de todo el volumen como en los sólidos. Esta ordenación próxima es inestable: puede aparecer o desaparecer por acción de las oscilaciones térmicas de gran energía.
Por lo tanto el estado líquido es una especie de estado intermedio entre el sólido y el gaseoso, este fenómeno se llama sublimación.
La distribución regular de las partículas en el espacio caracteriza el estado cristalino. Por esto el estado cristalino y el estado sólido son sinónimos en la física.
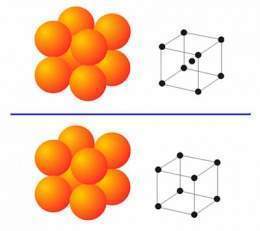
Redes cristalinas de los metales
Cuando los metales solidifican desde el estado fundido al estado sólido, los átomos se ordenan a si mismos de una manera peculiar para cada metal. A este arreglo se le llama red espacial. En 1912, Max Von Laue, descubrió que la disposición de las partículas (iones) en un sólido podía determinarse mediante rayos X, con esto se descubrió que: en la mayoría de los sólidos, las partículas que los componen se disponen en forma muy ordenada. Un sólido que posee sus partículas individuales dispuestas de esta manera se denomina "sólido cristalino"; los metales son sólidos cristalinos, este tipo de sólidos poseen también un punto de fusión bien definido (para el hierro, este es de 1539°C)
Estructuras reticulares
Los metales solidifican en seis estructuras reticulares principales:
- Cúbica centrada en el cuerpo (b.c..c)
- Cúbica centrada en las caras (f.c.c.)
- Hexagonal compacto (c.p.h.)
- Cúbica
- Tetragonal centrado en el cuerpo
- Romboédrica
Sin embargo, la mayor parte de los metales puros en estado sólido forman una de las siguientes redes cristalinas simétricas: cúbica centrado en el cuerpo, cúbica centrada en las caras y hexagonal compacta.
La disposición mutua de los átomos en el espacio y la magnitud de las distancias entre ellos se determinan por medio del análisis estructural roentgenográfico.
La distribución de los átomos en el cristal conviene representarla por esquemas espaciales en forma de las llamadas celdillas elementales o celdillas unidad. Se entiende por celdilla elemental el menor conjunto de átomos que al repetirse muchas veces en el espacio permite reconstruir la red cristalina espacial.
Mecanismo de cristalización
En el año 1878, D.K. Chernov, cuando estudiaba la estructura del acero fundido, indicó que el proceso de cristalización consta de dos procesos elementales. El primer proceso consiste en la formación de partículas pequeñísimas de los cristales, a las que dio el nombre de "gérmenes2 y que ahora se llaman centros o núcleos de cristalización. El segundo proceso es el de crecimiento de los cristales a partir de estos centros.
El proceso de formación de los cristales por generación de los centros de cristalización y de su crecimiento puede estudiarse valiéndose de los modelos de I.L. Mirkin.
La velocidad de todo proceso de cristalización está determinada cuantitativamente por dos magnitudes: la velocidad de formación de los centros de cristalización y la velocidad de crecimiento de los cristales. Estas dos magnitudes pueden medirse para las diversas condiciones de cristalización.
Enlaces relacionados
Enlaces externos
- Formas alotrópicas del hierro y sus combinaciones con el carbono
- Cristalización de los metales
- Redes cristalinas de los metales
Fuentes
- Guliáev, A. P. Metalografía. Tomo I. Editorial Mir Moscú.
- Guliáev, A. P. Metalografía. Tomo II. Editorial Mir Moscú.