Isomería
| ||||||
Isomería. Propiedad de ciertos compuestos químicos con igual fórmula química, es decir, iguales proporciones relativas de los átomos que conforman su molécula presentan estructuras moleculares distintas y, por ello, diferentes propiedades. Aunque este fenómeno es muy frecuente en los compuestos del carbono, no es exclusiva de ellos pues también la presentan algunos compuestos inorgánicos, como los compuestos de los metales de transición.
Sumario
¿En qué consiste la isomería?
El fenómeno de la isomería en la Química, es semejante al fenómeno de la existencia de palabras diferentes por la permutación de las letras, como por ejemplo: AMOR y ROMA, AVE y EVA, ASÍ e ISA, ZORRA y ARROZ, SABES y SEBAS, ADULA y ALUDA, etc. que son palabras palíndromas que se pueden leer al derecho y al revés tienen significados diferentes, en química tienen en común (mismas letras, "iguales" fórmulas moleculares; diferentes acomodaciones "diferentes" fórmulas estructurales).
Los isómeros son compuestos diferentes que poseen la misma composición química, es decir, el mismo número y tipo de átomos y por consiguiente las mismas formulas moleculares pero estructura diferentes, además de presentar propiedades químicas y/o físicas diferentes. Los isómeros están relacionados entre sí de dos maneras ya sea por sus fórmulas estructurales o por sus estructuras tridimensionales. La isomería comprende la estructural y la esteroisomería.
Tipos básicos de isomería
Isómeros estructurales
- De cadena: Los isómeros tienen cadenas carbónicas diferentes, o sea la disposición de los átomos en la cadena suele ser diferente.
a) Cadena abierta - cadena cerrada.
b) Cadena normal y cadena ramificada.
c) Cadena homogénea vs. Cadena heterogénea, está en dependencia del radical alquílico que está unido a la cadena.
- De posición: Los isómeros tienen la misma cadena carbónica, pero difieren por la posición de radicales, o grupos funcionales que los identifican (enlaces dobles o triples).
a) Diferente posición del radical.
b) Diferente posición de un grupo funcional.
c) Diferente posición de una insaturación.
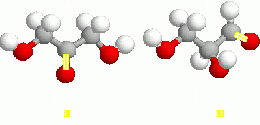
- De función: Los isómeros conservan el esqueleto carbonado, pero varía el grupo funcional. así el C3H6O puede corresponder tanto a al Propanal (aldehído) -CH3-CH2-CH0- como a la Propanona (cetona) -CH3-CO-CH3.
Estereoisomería
Los estereoisómeros tienen el mismo tipo y número de ligandos y el mismo tipo de unión, pero difieren en la forma en que los ligandos ocupan el espacio alrededor del metal central.
- Conformacional: Se caracterizan por poder interconvertirse (modificar su orientación espacial, convirtiéndose en otro isómero de la misma molécula) a temperatura ambiente, por rotación en torno a enlaces simples anti, eclipsada o alternada. Son compuestos que, generalmente, no pueden aislarse físicamente, debido a su facilidad de interconversión.
- Configuracional:
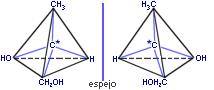
a) Enantiometría: Un complejo quiral es aquel cuya geometría no es superponible con la de su imagen especular. Dos complejos quirales, cada uno de los cuales es la imagen especular del otro se conocen como isómeros ópticos. Los dos isómeros ópticos forman un par de enantiómeros. Los isómeros ópticos se denominan así porque son ópticamente activos, es decir, un enantiómero gira el plano de la luz polarizada en una dirección y el otro rota dicho plano el mismo ángulo pero en dirección contraria.
b) Diastereometría: Son una clase de estereoisómeros tales, que no son superponibles pero tampoco imagen especular uno del otro, es decir, no son enantiómeros. Los diastereoisómeros difieren en sus propiedades físicas y químicas. Dentro del grupo de los diasterómeros se encuentran los isómeros cis-trans (antes conocido como Isómeros Geométricos), los confórmeros o isómeros conformacionales y, en las moléculas con varios centros quirales, los isómeros que pertenecen a distintas parejas de enantiómeros. Al poseer los diasteroisómeros propiedades físicas diferentes, estos pueden separarse mediante procedimientos de destilación, cristalización o cromatografía.
Formas R y S del bromoclorofluorometano.
Si una molécula tiene n átomos de Carbono asimétricos, tendrá un total de 2n isómeros ópticos.
También pueden representarse estos isómeros con las letras (R) y (S). Esta nomenclatura se utiliza para determinar la configuración absoluta de los carbonos quirales. Hay tres sistemas de nombrar estos compuestos:
- Según la dirección de desviación del plano de la luz polarizada (Formas + y -)
- Según la configuración (Formas D y L) y según la configuración absoluta (formas R y S).
Mezcla racémica y formas meso
Enantiómeros del ácido láctico o 2-hidroxipropanoico.
Una mezcla racémica es la mezcla equimolecular de los isómeros dextro y levo. Esta fórmula es ópticamente inactiva (no desvía el plano de la luz polarizada). La mezcla de ácido D-láctico y L-láctico forma una mezcla racémica, ópticamente inactiva.
Si un compuesto posee dos carbonos asimétricos, puede tener uno dextrógiro y otro levógiro, pero si tiene un plano de simetría, en conjunto se comporta como ópticamente inactivo y recibe el nombre de forma meso. Es el caso del ácido tartárico o 2,3-dihidroxibutanodioico, uno de cuyos isómeros es una forma meso.
Poder rotatorio específico, es la desviación que sufre el plano de polarización al atravesar la luz polarizada una disolución con una concentración de 1 gramo de sustancia por cm³ en un recipiente de 1 dm de anchura. Es el mismo para ambos enantiómeros, aunque de signo contrario. Se mide con el polarímetro.
Isomería en Química Inorgánica
Hay varios tipos de isomería presente en compuestos inorgánicos, sobre todo en complejos de coordinación pero este fenómeno no es tan importante como en química orgánica:
- Isomería estructural o topológica: Los átomos se unen de modo diferente, como en el S2F2, de los que existe una molécula en forma de cadena y otra en forma de pirámide triangular. Un caso especial es la tautomería, en la que un átomo de H cambia de posición.
- Isomería conformacional: Igual a la ya comentada para compuestos orgánicos. Se presenta en compuestos con enlace sencillo como P2H4 o el ión ditionito, S2O4-2, donde existen formas eclipsadas, escalonadas y sinclinal (gauche).
- Isomería cis-trans (geométrica): Aparece en compuestos como el ácido nitroso, HNO2, o en complejos de coordinación plano-cuadrados como [PtCl2(NH3)2].
- Isomería de posición: Como en algunos heterociclos de azufre y nitrógeno. En el S6(NH)2 se mantiene el anillo octogonal del azufre pero dos átomos de azufre han sido sustituidos por grupos NH, que pueden estar en posición 1,2; 1,3; 1,4 y 1,5.
- Isomería óptica: También aparece en compuestos de coordinación de estructura tetraédrica con sustituyentes diferentes.
- Isomería de ionización: Se intercambian un ligando del catión con uno delos aniones que lo neutralizan, como ocurre entre [CrSO4(NH3)5]Cl y [CrCl(NH3)5]SO4
- Isomería de coordinación: Si ambos iones son complejos, podemos intercambiar sus ligandos y obtendremos isómeros diferentes, como ocurre entre [Co(NH3)6][Cr(CN)6] [Cr(NH3)6][Co(CN)6].
Isomería de enlace en un complejo de Cobalto
- Isomería de enlace: Algunos ligandos pueden unirse de modo diferente al ión central, como ocurre en [CoCl(NO2)(NH3)4]+ [CoCl(ONO)(NH3)4]+[7]
- Isomería de polimerización: Es el caso de NO2 y N2O4, dos óxidos de nitrógeno gaseosos.
Véase también
Enlaces externos
Fuente
- Química: Teoría y problemas. José Antonio García Pérez y otros. Ed. Tébar Flores. Albacete, 1996. ISBN: 8473601559 .Pág. 253 y ss.
- Robert Thornton Morrison, Robert Neilson Boyd. Química orgánica. . 5ª ed., Editorial Pearson Educación, 1998. ISBN: 9684443404. Pág. 421
- Carl David Gutsche. Fundamentos de química orgánica. Editorial Reverté, 1979. ISBN: 8429174753. Pág.67
- Química general; 8ª edición; Petrucci, Harwood y Herring; Prentice Hall; ISBN:0-13-014329-4
- Eduardo Primo Yúfera. Química orgánica básica y aplicada: de la molécula a la industria, Volumen 1. . Editorial Reverté, 1996. ISBN: 8429179534, Pág. 52 y ss.
- TheFreeDictionary
- Clasificación de los isómeros
- Estereoquímica
- Tipos de isómeros