Melanoma de coroides
Melanoma de Coroides. Es el tumor intraocular maligno más común en adultos. Aproximadamente un 50% de los pacientes desarrollan metástasis, especialmente a hígado, lo que disminuye la tasa de supervivencia y hace fatal la enfermedad. A pesar de los avances en diagnóstico y tratamiento, la tasa de mortalidad no ha cambiado mucho en los últimos 30 años, lo que exige un mayor conocimiento del comportamiento molecular de la enfermedad.
Epidemiología
Los melanomas oculares pueden desarrollarse en la úvea, en el 98% de los casos; o en la conjuntiva . La úvea está compuesta por la coroides, el iris y el cuerpo ciliar. La coroides es uno de los sitios más irrigados del cuerpo, y se ubica entre la retina y la esclera. La gran mayoría de los melanomas uveales se ubican en la coroides, y menos del 10% se ubican en el cuerpo ciliar o en el iris. A pesar de que el melanoma uveal es una enfermedad poco común, el melanoma coroideo es el tumor primario intraocular maligno más común y el segundo más común de los melanomas del cuerpo. Es una condición potencialmente letal para el ojo y a menudo afecta a personas caucásicas del norte de Europa o sus descendientes. Su incidencia en caucásicos europeos es de 7 por millón por año y en Estados Unidos de Norteamérica es de 6 por millón por año. Su incidencia en personas de raza negra es rara, de 0,31 por millón por año, lo que puede sugerir un rol protector por parte de la melanina del ojo. Asiáticos e hispánicos tienen un riesgo intermedio entre caucásicos y negros. Rara vez se diagnostica en niños. La edad promedio de diagnóstico es a los 55-60 años, y es ligeramente más frecuente en hombres.
Factores de riesgo
Dentro de los factores de riesgo para desarrollar melanoma coroideo se encuentran tener piel delgada, nevus cutáneos, sufrir de melanocitosis congénita ocular o de neurofibromatosis. Hay factores que influyen en que un nevus coroideo se desarrolle a melanoma, tales como un mayor grosor, fluido subretinal, la existencia de síntomas, de pigmento anaranjado, de un disco marginal, vacío ultrasonográfico y ausencia de halo. La exposición aguda o intensa a la luz ultravioleta también aumenta el riesgo, y se desconoce el riesgo asociado a la exposición crónica o aguda a la luz solar. También puede ser que el 6-10% de los pacientes tengan otra neoplasia primaria. Los factores de riesgo más fuertes para la enfermedad siguen siendo el linaje y los factores genéticos. Se conocen ciertas alteraciones citogenéticas asociadas al melanoma uveal, como resultado de la inestabilidad en los cromosomas, dándose separaciones anormales de las cromátidas durante la mitosis. Entre ellas se encuentran la pérdida parcial o total del cromosoma 3 (esta última llamada monosomía 3). También está la ganancia de 8q, que se presenta como una isodisomía o como una trisomía del 8; la ganancia de 6p, que se da por la formación de un isocromosoma; la pérdida de 1p (asociado con metástasis), la pérdida de de 6q y la pérdida 8p (3,10). Modificaciones genéticas que se asocian con mal pronóstico son la pérdida del cromosoma 3 y la ganancia de 8q, la ganancia de 6p, la pérdida de 8p y la pérdida de 1p (1,3). Mutaciones en la subunidad alfa de la proteína transportadora de guanina (GNAQ) se dan en un 80% de los casos de melanoma coroideo.
Diagnóstico
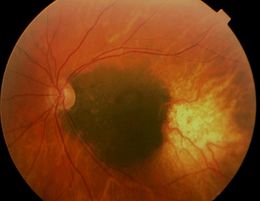
Los tumores coroideos medianos y grandes se identifican muy bien con técnicas de imagen, por lo que tan solo un 1% de los casos se diagnostica mal. El mejor diagnóstico se basa en la clínica del paciente y en técnicas como oftalmoscopía indirecta (OI), ultrasonografía A y B, angiografía del fondo con fluoresceína, citología por aspiración con aguja fina y autofluorescencia. Muchos pacientes son asintomáticos, y otros pueden tener síntomas como pérdida de la visión, fotopsia y defectos del campo visual. La pérdida de la visión se asocia a la invasión de la fóvea, al desprendimiento de la retina que involucre la mácula, o al contacto del tumor con el lente. El dolor severo es poco usual, a no ser que haya inflamación intraocular o una extensión extraocular masiva del tumor. La oftalmoscopía indirecta (OI) es el análisis más importante, llegando al diagnóstico en más del 95% de los casos. El melanoma coroideo usualmente es pigmentado, en una variedad de pigmentos, o bien, no pigmentado. El más común se presenta con un pigmento naranja (lipofuscina) a nivel del epitelio pigmentario de la retina. Algunos melanomas más grandes, especialmente si involucran al cuerpo ciliar, tienen vasos episclerales prominentes. La presencia de hemorragia asociada al tumor es rara y no es común observar inflamación intraocular. Mediante una OI (ver figura 1), la apariencia clásica inicial de un melanoma de coroides es en forma de domo, y se puede observar la formación de varias capas del epitelio pigmentario de la retina, acumulación de lipofuscina, drusas y un desprendimiento seroso del epitelio pigmentario de la retina (especialmente si el tumor es mayor de 4 mm de grosor). Pueden presentarse melanomas coroideos amelanocíticos, o ligeramente pigmentados, y en estos casos es la proliferación del epitelio pigmentario de la retina lo que le da color oscuro al melanoma. Esa proliferación del epitelio pigmentario de la retina causa degeneración y atrofia de la retina, apareciendo síntomas como metamorfopsia, visión borrosa, pérdida del campo visual y fotopsia. Muchos melanomas rompen la membrana de Bruch y el epitelio pigmentario de la retina, prolapsándose al espacio subretinal. Debido a que la membrana de Bruch es rígida, puede causar una especie de estrangulación del tumor, causando congestión venosa y edema intersticial, el tumor toma forma de hongo, lo cual es patognomónico de melanoma coroideo. Algunos tumores pueden invadir la retina y alcanzar el vítreo. El tumor podría expandirse hacia el cuerpo ciliar, iris y ángulo, y rara vez posteriormente hacia el disco óptico. Aproximadamente 5% de los melanomas coroideos son difusos, y se extienden como una capa delgada alrededor de la úvea, sin formar ningún nódulo. Cuando la retina se ha desprendido tiende a ser isquémica, liberando factores vasoproliferativos, que junto con los que vienen del tumor, producen rubeosis y glaucoma neovascular. El tumor puede infartarse, causando uveítis, y en casos severos producir panoftalmitis, celulitis orbitaria y edema palpebral. En cuanto a las Ultrasonografías A y B, éstos son los análisis secundarios más importantes. En la tipo A, el melanoma coroideo se ve con ecos internos de bajos a medios, con atenuación suave; y también se pueden ver pulsaciones vasculares dentro del tumor. Con la tipo B, se pueden reconocer 3 características clásicas: una zona acústicamente silenciosa dentro del melanoma, excavación coroidea, y sombreado en la órbita. La ultrasonografía A y B ayuda en el diagnóstico en el 95% de los casos, cuando el melanoma mide más de 3 mm de grosor. En un estudio realizado con 1739 pseudomelanomas, se encontró que 49% de ellos habían sido diagnosticados como melanomas, siendo realmente nevus coroideos. Los nevus son ecodensos y mínimamente vascularizados. La exactitud para diagnosticar el melanoma coroideo de la angiografía con fluoresceína es limitada. En tumores grandes se pueden ver algunas características, pero no son patognomónicas, como circulación tumoral intrínseca (doble circulación), fuga de fluorescencia progresiva extensa, una tinción tardía de la lesión, y múltiples fugas a nivel del epitelio pigmentario de la retina.La angiografía con verde de indocianina es capaz de evidenciar la microcirculación de los melanomas coroideos. En la tomografía óptica coherente (OCT), los melanomas demuestran una retina de grosor normal y fotoreceptores intactos, pero son evidentes el desprendimiento seroso de la retina y detritos detrás de la retina. Los nevus cuentan con pérdida de fotoreceptores en el 50% de los casos, escotoma absoluto, atrofia retinal con adelgazamiento, y desprendimiento del epitelio pigmentario en 15% de los casos. En cuanto a la autoflorescencia, los melanomas tienen grumos de autoflorescencia con evidente color naranja, a diferencia de los nevus coroideos que no tienen autoflorescencia. La citología por aguja fina es un método invasivo y mórbido que ha dejado de usarse, debido a complicaciones como esparcir las células tumorales al introducir la aguja. Sin embargo, el tejido obtenido mediante biopsias o estudios posteriores a la enucleación, han permitido estudiar la estructura y composición celular de los melanomas coroideos. Pueden estar formados por células en forma de huso, por células epiteliodes o por una mezcla de ambos tipos. Las células epiteliodes son grandes con citoplasma abundante, borde bien definido, y con amplio espacio extracelular entre ellas. Presentan núcleos eosinofílicos y grandes nucleólos. Las células en forma de huso son más pequeñas, menos pleomórficas, largas y angostas, con núcleos más pequeños y poco espacio extracelular entre ellas. A menudo contienen linfocitos y macrófagos, cuyo número aumentado se asocia con una alta mortalidad. En un estudio realizado en India, se encontró que en esa población predominan los melanomas formados por células en forma de huso, lo que pone en evidencia la fuerte influencia de la genética en la enfermedad. La neovascularización es una respuesta natural en los melanomas coroideos. Los pequeños vasos pueden acomodarse en patrones característicos que se asocian con el pronóstico del paciente. El peor pronóstico lo tienen los pacientes con vascularizaciones dispuestas en forma de bucles. Otras pruebas auxiliares son una tomografía computarizada de alta resolución, pero es menos exacta que la ultrasonografía. Hay técnicas invasivas como la captura de fósforo radioactivo (que ya no se utiliza por dar muchos falsos positivos y falsos negativos). El diagnóstico diferencialdebe hacerse con los nevus coroideos, ya que un tumor muy pequeño es difícil de diferenciar de un nevus grande. Las principales características que permiten diferenciar un melanoma coroideo pequeño de un nevus son un grosor mayor a 2 mm, fluido subretinal, la existencia de síntomas, pigmento anaranjado y márgenes que alcanzan el disco óptico. Al observar la OI, la presencia de un color púrpura-anaranjado es más típica de un hemangioma coroideo, o de un osteoma coroideo temprano. Pigmentación oscura o negra es más comúnmente vista junto con hipertrofia del epitelio pigmentario de la retina o hiperplasia. Muy pocos casos se presentan sin pigmento, y se podría también sospechar de un hemangioma coroideo, o de metástasis de otras neoplasias. Es necesario diferenciar del melanocitoma, tumor linfoide benigno, hemangio-pericitoma coroideo, leiomioma coroideo, lesión extramacular disciforme, ruptura de un macroaneurisma arteriolar, desprendimiento coroideo localizado, escleritis posterior, desprendimiento hemorrágico de la retina, gliosis retinal masiva, glioma retinal, granuloma corioretinal.
Tratamiento
Para elegir el tratamiento se toma en cuenta la agudeza visual del ojo afectado y del ojo contralateral, el tamaño del tumor, la ubicación, estructuras oculares involucradas, y si hay metástasis. Si el melanoma es pequeño (diámetro longitudinal de 1-3 mm, diámetro antero-posterior <5 mm) y está ubicado en el fondo posterior, se puede someter a varias opciones de tratamiento, como la fotocoagulación con láser, terapia fotodinámica, terapia de radiación en placa, radiación con un haz de partículas cargadas externamente, termoterapia transpupilar, resección quirúrgica y enucleación. Si el melanoma es mediano (diámetro longitudinal de 2,5-10 mm, diámetro antero-posterior <16 mm) o grande (diámetro longitudinal >10 mm, diámetro antero-posterior >16 mm); la enucleación es una opción, sobre todo si el melanoma causa glaucoma severo o invade el nervio óptico, si es difuso o si se ha extendido extraocularmente. Hacer radiación antes de la enucleación no marca la diferencia, ya que complicaciones posteriores a la radiación o recurrencia del tumor finalizan en enucleación. Si se trata de conservar el ojo, la braquiterapia de placa es el tratamiento más utilizado. Se utilizan placas de yodo-125, oro-198 y paladio-103 para causar la regresión del tumor. Los resultados son alentadores, pero puede haber complicaciones de la radioterapia como retinopatía, cataratas, hemorragia en el vítreo y glaucoma neovascular. Se prefiere usar yodo-125 por su baja emisión de energía (falta de rayos alfa y beta), buena penetración tisular y disponibilidad comercial. La placa radioactiva permanece en el ojo de 3-7 días, en función del tamaño del tumor y de la liberación de radiación. A largo plazo, no hay diferencia entre el tratamiento con braquiterapia o la enucleación, si se asocia a la mortalidad por metástasis del melanoma. Tratar con un haz de partículas cargadas externamente, como iones helio o protones, puede tener algunas ventajas, como una irradiación más óptima para todo el tumor y no dañar mucho los tejidos aledaños, además se pueden tratar tumores que abarquen hasta 30% del globo ocular. La resección de la pared del ojo permite retirar todo el tumor junto con la esclera y retina adyacentes, colocando posteriormente una esclera donada. Se han investigado nuevos agentes como el Ipilimumab. Se trata de inmunoterapia con anticuerpos monoclonales que bloquean un antígeno en los linfocitos T citotóxicos. Este antígeno es el CTLA-4 (Cytotoxic T-Lymphocyte Antigen 4) y su función es inhibir la activación y proliferación de los linfocitos T citotóxicos. El Ipilimumab inhibe la vía de señalización del CTLA-4, estimulando la proliferación y activación de los linfocitos T, facilitando la destrucción de las células tumorales. En casos donde ya se ha detectado metástasis a otras partes del cuerpo, el tratamiento del melanoma ocular se vuelve paliativo y la quimioterapia es el tratamiento de elección.
Metástasis
Se han descrito indicadores de mal pronóstico como el tamaño del melanoma, la presencia de células epiteliodes, la tasa de mitosis de las células tumorales y los patrones vasculares específicos. A pesar de los múltiples avances en diagnóstico y tratamiento del melanoma coroideo, se ha visto que cerca del 50% de los pacientes desarrollan metástasis. La mayoría de las metástasis se dan aproximadamente 5 años luego del tratamiento primario y se ha visto que si no hay historia de otras enfermedades oculares, hay más probabilidad de metástasis. Algunos estudios han demostrado que la metástasis puede darse temprano en la enfermedad, cuando el tumor mide aproximadamente 3 mm en su base y 1,5 mm de grosor. Por ejemplo, 16% de los pacientes con melanomas pequeños de coroides (<4 mm de grosor) sufrieron metástasis a los 5 años de diagnóstico. La tasa de mortalidad no ha cambiado mucho desde 1973. La tasa de supervivencia a los 5 años es de 65%, a los 10 años es de 52% y a los 15 años es de 46%. Sitios comunes de metástasis son el hígado (90% de los casos), pulmón (24%), piel y hueso (16%). Según el perfil genético del melanoma, pueden agruparse en tumores de clase 1 o tumores de clase 2, siendo éstos últimos los que tienen más capacidad de hacer metástasis. El transcriptoma de los tumores de clase 1 difiere ligeramente del que poseen los melanocitos uveales normales, lo cual sugiere que han ocurrido pocos cambios genéticos. Por el contrario, el transcriptoma de los tumores de clase 2 difiere bastante con respecto al de los melanocitos normales, y más bien se parece al de las células ectodermales primitivas. Así por ejemplo, la monosomía 3 es un hallazgo frecuente en los tumores de clase 2; incluso se cree que los cambios establecidos por la pérdida del cromosoma 3 son los responsables del cambio global en la expresión genética que caracteriza a los tumores clase 2. De manera significativa, en los tumores de clase 2 se presentan más aneuploidías, lo que indica inestabilidad genómica generalizada, si se compara con los tumores de clase 1. Sin mbargo, aún no queda clara la razón por la cual los tumores de clase 2 hacen más metástasis que los de clase 1. Se ha visto que la pérdida de 8p se asocia con un aumento en la migración e invasión de las células del melanoma, pero esta característica se da en tan solo 25% de los tumores de clase 2. En los últimos años se ha estudiado el anticuerpo contra Ki-67, que es un antígeno nuclear que se expresa en células en proliferación, y ausente en células en reposo. Se ha encontrado una asociación significativa entre una positividad aumentada de Ki-67 y el perfil de los tumores de clase 2. El que haya mayor expresión de Ki-67 significa que hay más proliferación celular, lo que aumenta el riesgo de mutaciones celulares. Además, la mayoría de anormalidades cromosómicas ocurren durante la división celular, por lo que células en una alta tasa de división se hacen vulnerables a inestabilidad cromosómica y aneuploidías, lo que concuerda con el perfil de tumores de clase 2. No se conoce la razón por la cual el hígado es el sitio más común de metástasis, ya que el ojo carece de vasos linfáticos y la diseminación se da vía hematógena. De hecho, las células que vienen del tumor primario transitan primero por los capilares pulmonares sin crear ahí focos de metástasis. Cuando se detecta metástasis a hígado, las opciones de tratamiento son limitadas, y la esperanza de vida disminuye a menos de 3 años. En algunos estudios se ha visto que altos niveles en la expresión de c-Met en el tumor primario se asocian con riesgo elevado de desarrollar metástasis a hígado. Esto se debe a que c-Met es el receptor del factor de crecimiento de los hepatocitos, lo que activa una serie de vías intracelulares que finalmente provocan el aumento en la expresión de genes que tienen que ver con la proliferación celular, el ciclo celular, resistencia a la apoptosis, aumento de la movilidad y de la capacidad invasiva. Es muy raro que se presente metástasis sólo a pulmón, sin que se vea involucrado el hígado. Durante el 2013, unos investigadores del Centro Médico Nagara en Japón, reportaron el caso de una mujer de 61 años con metástasis solitaria a pulmón, que había sido tratada por enucleación 13 años antes, lo cual también rompe los esquemas, pues la mayoría de las metástasis se dan 5 años después del diagnóstico y tratamiento del tumor primario. El melanoma coroideo de esta paciente estaba formado por células mixtas, medía 10 mm de grosor y 13 mm de diámetro. Hay otros marcadores genéticos que se asocian con la metástasis del tumor, por ejemplo el aumento en la expresión de E-cadherina y h-catenina en la membrana plasmática de las células tumorales; el aumento en la expresión del sustrato 2 del receptor de la insulina, de fibronectina 1 y citoqueratina 18; la isminución de vimentina y marcadores específicos de melanoma, como MelanA y CD63.
Fuentes
- A. Filloy, J.M. Caminal, M.M. Varela, M. Gomà, L. Arias, J. Arruga, Cytogenetic analysis of choroidal melanoma, Archivos de la Sociedad Española de Oftalmología (English Edition), Volume 89, Issue 1, January 2014, Pages 17-21
- Bertil E. Damato, Sarah E. Coupland, Ocular melanoma, Saudi Journal of Ophthalmology, Volume 26, Issue 2, April–June 2012, Pages 137-144.
- Cristina Miyamoto, Matthew Balazsi, Silvin Bakalian, Bruno F. Fernandes, Miguel N. Burnier Jr., Uveal melanoma: Ocular and systemic disease, Saudi Journal of Ophthalmology, Volume 26, Issue 2, April–June 2012, Pages 145-149.