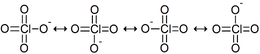Perclorato
| ||||||
El perclorato es un ión que se encuentra en forma natural en el medio ambiente, se forma en la atmósfera y se transfiere a suelos y agua, y se encuentra en depósitos de nitratos y de potasio a partir de los cuales se producen distintos fertilizantes. También se puede generar durante la degradación de hipoclorito de sodio usado para desinfección de agua
Sumario
Origen
Los percloratos son las sales del ácido perclórico HClO4, incolora e inodora. Hay cinco sales de percloratos que se manufacturan en grandes cantidades: perclorato de magnesio, perclorato de potasio, perclorato de amonio, perclorato de sodio y perclorato de litio. Estas sales se disuelven fácilmente en agua.
Pueden generarse por procesos naturales en el medio ambiente, en depósitos de nitrato y potasio, y se pueden formar en la atmósfera y el precipitado en el suelo y las aguas subterráneas pero también se pueden generar de la actividad humana y por la presencia en herbicidas, fertilizantes químicos, blanqueantes y otros agentes de limpieza.
El agua, el suelo y los fertilizantes se consideran fuentes potenciales de contaminación de percloratos en los alimentos y aunque las fuentes pueden ser muchas y diversas, se investiga si la fuente de la contaminación pudieran ser los fertilizantes a base de nitrato potásico o el uso de agua desinfectada con hipoclorito sódico, en los que el perclorato es una impureza.
Los consumidores pueden estar expuestos al perclorato a través de la dieta diaria, ya que está presente en muchos productos agrícolas. El principal órgano afectado por estas sales es la tiroides sobre la que actúa inhibiendo la incorporación de yodo, sobre todo en niños menores de 12 años.
El Sistema de Alerta Rápida para Alimentos y Piensos (RASFF) ha hecho público comunicados donde se informaba de la presencia de percloratos en algunos productos alimenticios españoles como el tomate. Esta noticia ha preocupado al sector y el control analítico se ha extendido a todo tipo de frutas y hortalizas.
Control del perclorato
El perclorato es un contaminante que posee la habilidad de competir con la absorción de yodo por parte de la tiroides, pudiendo en el largo plazo, y dependiendo de las concentraciones, producir hipotiroidismo, especialmente en poblaciones con deficiencias de yodo en la dieta y en niños menores de 12 años. Hasta ahora, no se han demostrado efectos en la salud derivados de la exposición a perclorato, en los niveles en los que este se presenta normalmente en el ambiente.
Propiedades de los Percloratos
• Los percloratos son compuestos muy oxidantes incluso más que los cloratos.
• Son sustancias comburentes (oxidantes) que alimentan la combustión de sustancias inflamables por lo que son muy peligrosos y deben ser alejados de combustibles o materiales fácilmente oxidables.
• Son sales solubles en el agua generalmente.
• Algunos percloratos reaccionan violentamente por lo que suelen emplearse en algunos tipos de explosivos.
• En los percloratos, el cloro está en valencia o estado de oxidación +7.
• Su geometría molecular es tetraédrica
• Los percloratos son relativamente estables
Aplicaciones de los Percloratos
Los Percloratos tienen aplicaciones importantes en múltiples campos. Algunos de los más importantes son:
• Son empleados en combustibles de cohetes por sus capacidades propelentes, especialmente el perclorato de amonio (NH4ClO4).
• Los cloratos y percloratos son muy utilizados en los artefactos pirotécnicos.
• Está presente en aplicaciones que requieran sustancias deflagrantes o propelentes.
• Se utilizan como agentes oxidantes.
• También están presentes en fósforos o cerillas.
• Los cloratos son también empleados como pesticidas o herbicidas.
• En la industria de los medicamentos se emplea el perclorato potásico (KClO4) para la fabricación de fármacos contra la tiroides como los antitiroideos.
Síntesis de los Percloratos
Las siguientes reacciones son ejemplos de síntesis de algunos percloratos:
Industrialmente se obtienen por oxidación de los Cloratos (ClO3−) a través de electrólisis. La reacción general es:
Reacción ClO3− + H2O → ClO4− + H2 (un clorato es disuelto en agua separándose en su ion ClO3−. A continuación se realiza una electrólisis consiguiendo la oxidación del ion clorato a perclorato).
• También se pueden preparar por la reacción de ácido Perclórico (HClO4) con bases:
HClO4 + NaOH → NaClO4 + H2O
2 HClO4 + Ca(OH)2 → Ca(ClO4)2 + 2 H2O
2 HClO4 + Cu(OH)2 → Cu(ClO4)2 + 2 H2O
3 HClO4 + Fe(OH)3 → Fe(CLO4)3 + 3 H2O
3 HClO4 + Al(OH)3 → Al(CLO4)3 + 3 H2O
2 HClO4 + Ba(OH)2 → Ba(CLO4)2 + 2 H2O
Fuentes
• B•VICENTE,J. ,yCHICOTE ,M .T.,Inorg.Chim.Acta,54,1259(1981).
• VICENTE,J. ;CHICOTE,M .T.,yBERMÚDEZ,M .D.,Inorg.Chim.Acta,63,35(1982).
• UsON,R.;LAGUNA,A.,yVICENTE,J. ,Rev.Acad.CienciasZaragoza,31,211(1976).
• BosCHi,T.;CROCIANI,B. ;CATTALINI,L.,yMARANGONI,C ,J.Chem.Soc,A,2408