Diferencia entre revisiones de «Ácido oxálico»
(Página creada con '{{Elemento_químico |nombre=Ácido Oxálico |imagen= Acido-oxalico.png |nombre,simbolo,numero=C<sub>2</sub>H<sub>2</sub>O<sub>4</sub>.2H<sub>2</sub>O |serie_quimica= |grupo,peri...') |
(→Propiedades) |
||
| Línea 32: | Línea 32: | ||
Se obtiene pasando [[Monóxido de Carbono]] por una [[Solución (Química)|solución]] concentrada y caliente de [Hidróxido de sodio]] a presión y a continuación conversió del Formiato de Sodio formado en Oxalato y convirtiendo este último en ácido. También el [[Aserrín]] tratado con ácidos o álcalis diluidos da una solución que contiene Ácido Oxálico u Oxalato del álcalis. | Se obtiene pasando [[Monóxido de Carbono]] por una [[Solución (Química)|solución]] concentrada y caliente de [Hidróxido de sodio]] a presión y a continuación conversió del Formiato de Sodio formado en Oxalato y convirtiendo este último en ácido. También el [[Aserrín]] tratado con ácidos o álcalis diluidos da una solución que contiene Ácido Oxálico u Oxalato del álcalis. | ||
| + | |||
| + | Su fórmula estructural desarrollada es la siguiente: | ||
| + | : O O–H | ||
| + | : \\ / | ||
| + | : C–C + 2H<sub>2</sub>O | ||
| + | : / \\ | ||
| + | :H–O O | ||
==Aplicaciones== | ==Aplicaciones== | ||
| Línea 58: | Línea 65: | ||
==Fuente== | ==Fuente== | ||
*Diccionario Químico. Tomo 1 - Ácidos. Edición Ministerio de Comercio Exterior. La Habana, 1963. | *Diccionario Químico. Tomo 1 - Ácidos. Edición Ministerio de Comercio Exterior. La Habana, 1963. | ||
| + | *[http://www.oxalato.com/cido_oxlico Ácido Oxálico] | ||
[[Category:Química]] | [[Category:Química]] | ||
Revisión del 08:18 1 nov 2011
| ||||||||||
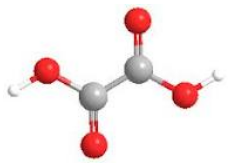
El Ácido Oxálico también conocido como Ácido Dicarboxílico o Ácido Etanodioico, es un ácido orgánico que responde a la fórmula general C2H2O4.2H2O.
Propiedades
Se presenta en forma de cristales incoloros e inodoros, de sabor ácido. Calentado ligeramente efloresce, a 70oC queda anhidro (sin agua), a 100 oC empieza a sublimar, a 160oC sufre la fusión ígnea y a temperaturas más elevadas se descompone.
Es soluble en 10 partes de agua y en 2,5 partes de alcohol; es poco soluble en éter. Debe evitarse el contacto con la piel, pues produce irritación.
Se obtiene pasando Monóxido de Carbono por una solución concentrada y caliente de [Hidróxido de sodio]] a presión y a continuación conversió del Formiato de Sodio formado en Oxalato y convirtiendo este último en ácido. También el Aserrín tratado con ácidos o álcalis diluidos da una solución que contiene Ácido Oxálico u Oxalato del álcalis.
Su fórmula estructural desarrollada es la siguiente:
- O O–H
- \\ /
- C–C + 2H2O
- / \\
- H–O O
Aplicaciones
- En Química:
- Agente purificador en la fabricación de Glicerina.
- Obtención de Ácido fórmico mediante reacción con Glicerina.
- Obtención de Ésteres del Ácido fórmico.
- Obtención de Dextrina pura mediante hidrólisis del Almidón.
- Purificación del Ácido Tartárico.
- Eliminación de las últimas trazas de Cal en la fabricación del Cremor Tártaro y Ácido Glicólico.
- Reactivo analítico.
- Fabricación de colorantes intermedios.
- Purificación de la Estearina.
- Blanqueo de la paja.
- Lavado del Carbón.
- Regeneración de bujías coloreadas.
- Pulimento para metales.
- Eliminadores de Orina y Tinta.
- Curtiente.
- Agente limpiador en la elaboración de cerveza.
- Elaboración de tintas azules.
- Fotograbado y Litografía.
- Limpiador de vagones de ferrocarril.
- Agente anticloro y antiherrumbre en lavandería.
Fuente
- Diccionario Químico. Tomo 1 - Ácidos. Edición Ministerio de Comercio Exterior. La Habana, 1963.
- Ácido Oxálico