Diferencia entre revisiones de «Trióxido de arsénico»
(→Identificación) |
|||
| Línea 39: | Línea 39: | ||
== Identificación == | == Identificación == | ||
| + | Existen diversos métodos de identificación del Trióxido de arsenio. Entre ellos los más utilizados son los siguientes: | ||
| + | *Disolver 10 mL del ácido Arsenioso en unos 10 mL de agua hirviendo, ligeramente acidulada con [[Ácido clorhídrico]]. Al mezclar esta [[Solución (Química)|solución]] con [[Sulfuro de Hidrógeno|Ácido Sulfhídrico]] forma un precipitado amarillo. | ||
*Calentando el Ácido Arsenioso sobre [[carbón]] se desprenden vapores de olor intenso que deben aspirarse con mucho cuidado. | *Calentando el Ácido Arsenioso sobre [[carbón]] se desprenden vapores de olor intenso que deben aspirarse con mucho cuidado. | ||
| − | |||
== Aplicaciones Industriales == | == Aplicaciones Industriales == | ||
Revisión del 12:17 8 nov 2011
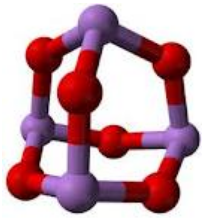
El Trióxido de arsénico es una sal inorgánica con fórmula As2O3 que puede encontrarse en dos formas diferentes:
- Amorfo: formando masas transparentes.
- Cristalino: formando masas blancas, opacas, parecidas a la porcelana. Esta es la forma más estable.
Sumario
Propiedades
Comúnmente se encuentra en trozos pesados de apariencia vítrea en el interior y porcelánica exteriormente. Se transforma lentamente en Anhídrido Arsenioso, cuya disolución constituye el Ácido Arsenioso. Este ácido, a temperatura suave, es soluble en agua, poco soluble en Alcohol y casi insoluble en éter.
Sublima (pasa de sólido a gas) a 193oC y la densidad depende del estado:
- Amorfo: 3.738
- Cristalino: 3.699
Es un veneno enérgico y debe manejarse con mucho cuidado
Identificación
Existen diversos métodos de identificación del Trióxido de arsenio. Entre ellos los más utilizados son los siguientes:
- Disolver 10 mL del ácido Arsenioso en unos 10 mL de agua hirviendo, ligeramente acidulada con Ácido clorhídrico. Al mezclar esta solución con Ácido Sulfhídrico forma un precipitado amarillo.
- Calentando el Ácido Arsenioso sobre carbón se desprenden vapores de olor intenso que deben aspirarse con mucho cuidado.
Aplicaciones Industriales
- Fabricación de pigmentos, vidrio, perdigones y balas.
- Fabricación de Insecticidas y Raticidas.
- Limpieza del ganado.
- Herbicida.
- Preservativo de pieles sin curtir.
- Fabricación decerámicas y esmaltes.
- Agente esterilizante en la purificación del agua.
Aplicaciones Médicas
- Antiperiódico.
- Antineurálgico en numerosas neuralgias.
- Empleado en afecciones cutáneas y en algunas formas de anemia.
- Tratamiento de tumores.
Enlaces relacionados
Fuente
- Diccionario Químico. Tomo 2 - Volumen I. Metales y No Metales y sus compuestos. Edición Universitaria. La Habana, 1965.
Veneno.png