Diferencia entre revisiones de «Óxido de fósforo (III)»
(Página creada con '{{Definición |nombre= Óxido de fósforo (III) | imagen= Trioxido_de_difosforo.jpg |tamaño= 201 × 133px |concepto=También conocido como trióxido de difósforo , óxido fos...') |
(→Enlace relacionado) |
||
| (No se muestran 6 ediciones intermedias de 5 usuarios) | |||
| Línea 1: | Línea 1: | ||
| − | {{ | + | {{Elemento_químico |
| − | |nombre= Óxido de fósforo (III) | + | |nombre=Óxido de fósforo (III) |
| − | | imagen= | + | |imagen=Oxido_de_fosforo_3.jpg |
| − | | | + | |nombre,fórmula=Óxido de fósforo (III) '''(P<sub>2</sub>O<sub>3</sub>)'' |
| − | | | + | |serie_quimica=Su fórmula molecular '''(P<sub>4</sub>O<sub>6</sub>)''',puede considerarse como el anhídrido del [[ácido fosforoso]] |
}} | }} | ||
| − | + | ||
| − | ''' Óxido de fósforo (III)''' | + | ''' Óxido de fósforo (III)'''. Según nomenclatura de stock también conocido por la nomenclatura sistemática como trióxido de difósforo , y por la nomenclatura tradicional como anhídrido fosforoso u óxido fosforoso, se presenta en forma sencilla monómera cuya fórmula estequiométrica es''' (P<sub>2</sub>O<sub>3</sub>)''' y sus dímeros, presentan como fórmula molecular '''(P<sub>4</sub>O<sub>6</sub>)''',puede considerarse como el anhídrido del [[ácido fosforoso]], forma una masa cristalina de [[color]] blanco, posee característica de [[ácido]] medio y es el anhídrido del tautómero inestable del [[ácido]] fosforoso. También es un ligando para los metales de transición. |
| − | + | ||
== Estructura == | == Estructura == | ||
| − | Su estructura es una modificación del tetraedro del P<sub>4</sub>, mediante la inserción de un átomo de [[ | + | |
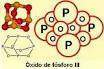
| + | Su estructura es una modificación del tetraedro del P<sub>4</sub>, mediante la inserción de un [[átomo]] de [[oxígeno]] entre cada dos de [fósforo]] | ||
| + | |||
== Propiedades físicas == | == Propiedades físicas == | ||
| − | El óxido de fósforo (III) de[[ masa molar]] 110g/mol, es considerado como el anhídrido de los denominados | + | |
| + | El óxido de fósforo (III) de [[masa molar]] 110g/mol, es considerado como el anhídrido de los denominados ácidos fosforosos. Forma una [[masa]] cristalina, de color blanco con aspecto de cera, que funde a 23,8 ºC con formación de un líquido relativamente poco volátil (en Cuba el óxido de fósforo (III) normamelmente se encuentra al estado líquído), al igual que el fósforo blanco, este óxido es muy tóxico. | ||
| + | |||
== Obtención == | == Obtención == | ||
| − | El óxido de fósforo (III) se produce por la combustión del | + | |
| + | El óxido de fósforo (III) se produce por la combustión del Fósforo | ||
| + | P<sub>4</sub>(s)+ 3O<sub>2</sub>(g)= P<sub>4</sub>O<sub>6</sub>(l) | ||
| + | Cuando el óxido se calienta a unos 200ºC en el vacío se transforma en tetróxido de fósforo junto con fósforo rojo. | ||
| + | |||
== Propiedades químicas == | == Propiedades químicas == | ||
| − | El óxido de fósforo (III) se combina lentamente con el | + | |
| + | El óxido de fósforo (III) se combina lentamente con el dioxígeno a [[temperatura]] ordinaria y a baja presiones, su oxidación produce una fosforescencia. | ||
| + | El óxido de fósforo (III) al estado gaseoso induce la ionización del aire circundante. | ||
| + | |||
| + | Reacciona lentamente con el [[agua]] fría con formación de ácido fosforoso | ||
| + | |||
| + | P<sub>4</sub>O<sub>6</sub>(l) + H<sub>2</sub>O(fría)=2H<sub>3</sub>PO<sub>4</sub>(ac) | ||
| + | |||
| + | Con [[agua]] caliente tiene lugar una vigorosa descomposición de fosfina (fosfamina) y ácido fosfórico | ||
| + | |||
| + | P<sub>4</sub>O<sub>6</sub>(l) + 6H<sub>2</sub>O(caliente)=3H<sub>3</sub>PO<sub>4</sub>(ac) + PH<sub>3</sub>(g) | ||
| + | |||
| + | Con el [[Cloruro de Hidrógeno]]forma [[tricloruro de fósforo]] y[[ ácido fosforoso]] | ||
| + | |||
| + | P<sub>4</sub>O<sub>6</sub>(l) + 6HCl(g) = 2H<sub>3</sub>PO<sub>3</sub>(ac)+ PCl<sub>3</sub>(ac) | ||
| + | |||
| + | También reacciona vigorosamente con di[[Cloro]], y di[[Bromo]]. | ||
| + | |||
== Referencias == | == Referencias == | ||
* Babor,J. A y J. Ibarz: Química General Moderna. Tomo II. Ed. Pueblo y Educación. [[Ciudad de La Habana]], [[Cuba]]. [[1962]]. <br> | * Babor,J. A y J. Ibarz: Química General Moderna. Tomo II. Ed. Pueblo y Educación. [[Ciudad de La Habana]], [[Cuba]]. [[1962]]. <br> | ||
* Blanco Prieto,J y J. Periera Simo: Química Inorgánica Parte II. Ed. Pueblo y Educación. [[Ciudad de La Habana]], [[Cuba]]. [[1986]]. <br> | * Blanco Prieto,J y J. Periera Simo: Química Inorgánica Parte II. Ed. Pueblo y Educación. [[Ciudad de La Habana]], [[Cuba]]. [[1986]]. <br> | ||
* Colectivo de autores: [[Química]]. Tomo I. Ed. Pueblo y Educación. [[Ciudad de La Habana]], [[Cuba]]. [[1969]]. <br> | * Colectivo de autores: [[Química]]. Tomo I. Ed. Pueblo y Educación. [[Ciudad de La Habana]], [[Cuba]]. [[1969]]. <br> | ||
| + | |||
== Fuentes == | == Fuentes == | ||
| − | * http://www.estrucplan.com.ar | + | * [http://www.estrucplan.com.ar estrucplan] |
| − | * http://books.google.com.cu | + | * [http://books.google.com.cu books.google] |
| − | + | ||
| − | + | [[Category:Compuestos_de_fósforo]] | |
| − | |||
[[Category:Química]] | [[Category:Química]] | ||
última versión al 09:11 19 jun 2013
| ||||||||
Óxido de fósforo (III). Según nomenclatura de stock también conocido por la nomenclatura sistemática como trióxido de difósforo , y por la nomenclatura tradicional como anhídrido fosforoso u óxido fosforoso, se presenta en forma sencilla monómera cuya fórmula estequiométrica es (P2O3) y sus dímeros, presentan como fórmula molecular (P4O6),puede considerarse como el anhídrido del ácido fosforoso, forma una masa cristalina de color blanco, posee característica de ácido medio y es el anhídrido del tautómero inestable del ácido fosforoso. También es un ligando para los metales de transición.
Sumario
Estructura
Su estructura es una modificación del tetraedro del P4, mediante la inserción de un átomo de oxígeno entre cada dos de [fósforo]]
Propiedades físicas
El óxido de fósforo (III) de masa molar 110g/mol, es considerado como el anhídrido de los denominados ácidos fosforosos. Forma una masa cristalina, de color blanco con aspecto de cera, que funde a 23,8 ºC con formación de un líquido relativamente poco volátil (en Cuba el óxido de fósforo (III) normamelmente se encuentra al estado líquído), al igual que el fósforo blanco, este óxido es muy tóxico.
Obtención
El óxido de fósforo (III) se produce por la combustión del Fósforo P4(s)+ 3O2(g)= P4O6(l) Cuando el óxido se calienta a unos 200ºC en el vacío se transforma en tetróxido de fósforo junto con fósforo rojo.
Propiedades químicas
El óxido de fósforo (III) se combina lentamente con el dioxígeno a temperatura ordinaria y a baja presiones, su oxidación produce una fosforescencia. El óxido de fósforo (III) al estado gaseoso induce la ionización del aire circundante.
Reacciona lentamente con el agua fría con formación de ácido fosforoso
P4O6(l) + H2O(fría)=2H3PO4(ac)
Con agua caliente tiene lugar una vigorosa descomposición de fosfina (fosfamina) y ácido fosfórico
P4O6(l) + 6H2O(caliente)=3H3PO4(ac) + PH3(g)
Con el Cloruro de Hidrógenoforma tricloruro de fósforo yácido fosforoso
P4O6(l) + 6HCl(g) = 2H3PO3(ac)+ PCl3(ac)
También reacciona vigorosamente con diCloro, y diBromo.
Referencias
- Babor,J. A y J. Ibarz: Química General Moderna. Tomo II. Ed. Pueblo y Educación. Ciudad de La Habana, Cuba. 1962.
- Blanco Prieto,J y J. Periera Simo: Química Inorgánica Parte II. Ed. Pueblo y Educación. Ciudad de La Habana, Cuba. 1986.
- Colectivo de autores: Química. Tomo I. Ed. Pueblo y Educación. Ciudad de La Habana, Cuba. 1969.