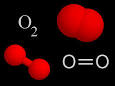
Oxígeno
Oxígeno, de símbolo O. Es un elemento gaseoso ligeramente Magnético, incoloro, inodoro e insípido; es vital en el Ciclo energético de los seres vivos y esencial en la respiración celular de los organismos aeróbicos. Es más Electronegativo que cualquier otro elemento, excepto el Flúor y forma compuestos con todos menos con los Gases nobles o inertes.
Sumario
Historia
El oxígeno no se reconoció hasta finales del Siglo XVIII. Quién primero lo preparó fue Scheele, un químico sueco, en 1772. Lo identificó como uno de los principales constituyentes del aire y lo llamó aire de fuego y aire de vitriolo. No obstante, a quien se considera generalmente como su descubridor es a Priestley, puesto que publicó sus resultados en 1774, mientras que Scheele retrasó su publicación hasta 1777. En su preparación original, Priestley calentó lo que hoy se conoce como Óxido de mercurio, HgO, y observó el desprendimiento de un gas. A este gas lo denominó aire deflogistizado y observó que aumentaba la brillantez de una llama. Sin embargo, fue Lavoisier quien reconoció en el nuevo gas un elemento y lo llamó oxígeno en 1777 (del griego oxy genes formador de ácidos).
Abundancia y estado natural
Es el elemento más abundante de la Corteza terrestre, tanto en masa como en número de átomos. Los átomos de oxígeno son más numerosos que los de todos los demás elementos juntos.
Constituye el 21% en volumen o el 23,15% en masa de la Atmósfera, el 85,8% en masa de los Océanos (el agua pura contiene un 88,8% de oxígeno), el 46,7% en masa de la corteza terrestre (como componente de la mayoría de las Rocas y Minerales). El oxígeno representa un 60% del Cuerpo humano. Se encuentra en todos los tejidos vivos. Casi todas las Plantas y Animales, incluyendo los seres humanos, requieren oxígeno, ya sea en estado libre o combinado, para mantenerse con vida.
Los más abundantes de los minerales que contienen oxígeno son los que incluyen además silicio; el más sencillo de los cuales es la sílice, SiO2, principal constituyente de la arena. Entre los que carecen de silicio, el que más abunda es el CaCO3. En la materia viva el oxígeno está combinado con los elementos Carbono, Azufre, Nitrógeno o Hidrógeno.
Obtención
Las fuentes industriales para obtener oxígeno son el aire y el agua.
- A partir del aire: Se extrae el oxígeno por licuefación y ulterior destilación fraccionada. El aire consta del 21% de oxígeno, 78% de nitrógeno y 1% de Argón, Neón, dióxido de carbono y vapor de agua. Primeramente se separan del aire estos dos últimos compuestos; a continuación se comprime, se enfría y se deja expandir, hasta que se produce la licuefación y se obtiene aire líquido. Después, este se deja evaporar parcialmente, con lo cual se vaporiza el nitrógeno, cuyo punto de ebullición es más bajo, dejando un residuo enriquecido en oxígeno. Mediante repetición cíclica de este proceso se llega a preparar un oxígeno del 99,5% de pureza.
- A partir del agua: Se obtiene oxígeno muy puro por Electrólisis, como subproducto en la preparación del hidrógeno.
- En los laboratorios: Se suele preparar por descomposición térmica del Clorato de postasio|Clorato de potasio KClO3. La reacción
se cataliza por la presencia de distintas sustancias sólidas, tales como el Dióxido de manganeso MnO2, óxido de hierro (III), arena fina o vidrio en polvo. Se cree que la misión del Catalizador es proporcionar una superficie suficiente para que pueda producirse el desprendimiento del oxígeno gaseoso.
Formas alotrópicas
El oxígeno presenta tres Formas alotrópicas:
- El dioxígeno, que contiene dos átomos por molécula y cuya fórmula es O2
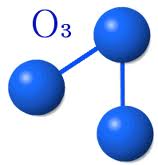
- El trioxígeno (ozono), que contiene tres átomos por molécula y cuya fórmula es O3
- El tetraoxígeno, una forma no magnética azul pálida, que contiene cuatro átomos por molécula, cuya fórmula es O4 y que se descompone fácilmente en oxígeno ordinario
Características del Ozono
Es un gas azulado a temperatura ordinaria, más reactivo que el oxígeno ordinario y sus puntos de fusión
y ebullición son mayores que los de la molécula de dioxígeno, lo que indica que las fuerzas intermoleculares son de mayor magnitud. Es muy poco soluble en agua y tiene un fuerte olor. Su nombre procede de la raíz griega ozein; podemos olerlo. Es termodinámicamente inestable y se descompone formando O2.
Se puede formar a partir de oxígeno en un arco eléctrico, como el descargador a distancia de un Motor eléctrico, también por la acción de la luz ultravioleta sobre el oxígeno; esto explica el aroma " fresco del aire durante las Tormentas eléctricas". Es una molécula diamagnética, extremadamente Tóxica (máxima exposición 0.1 ppm). Se produce en zonas con un alto voltaje Fotocopiadoras, Impresoras láser, etc.) y es causante de dolores de cabeza en ambientes de oficina. Sin embargo su presencia en la Troposfera nos protege de la radiación ultravioleta.
Propiedades químicas
El oxígeno es un no metal moderadamente activo, cuya electronegatividad ocupa el segundo lugar entre todos los elementos. Se combina directamente con todos los elementos, excepto con los metales nobles, como Plata, Oro, y Platino. Entre los no metales, no se combinan directamente con el oxígeno los gases nobles del grupo VIIIA y los Halógenos del grupo VIIA, altamente electronegativo, reacciona con facilidad con el carbono, azufre y fósforo.
Formación de óxidos metálicos o básicos
Aunque la oxidación es lenta, si se calienta un metal, pude producirse la Combustión. El Sodio arde fácilmente en el aire, formando, en lugar del óxido, el Peróxido.
El Magnesio y los Alcalinos-térreos del grupo II se oxidan o arden formando los óxidos normales.
El polvo del aluminio arde violentamente en el aire.
El hierro se oxida formando el familiar Óxido de hierro (III).
Formación de óxidos ácidos
Los óxidos de los metales son Óxidos ácidos. El carbono, el azufre y fósforo arden fácilmente, formando Dióxido de carbono, Dióxido de azufre y Pentóxido de difósforo, respectivamente:
Combustión del hidrógeno
La combustión del hidrógeno es un reacción fuertemente Exotérmica:
Combustión del carbono y sus compuestos
Este elemento forma dos óxidos: el Monóxido de Carbono (CO) y el dióxido, CO2. El primero contiene, relativamente, más carbono y menos oxígeno que el último.
El suministro de oxígeno(aire) es abundante, el monóxido arde, a su vez, produciendo el dióxido:
Aplicaciones
El dioxígeno tiene un buen número de aplicaciones en el mundo moderno. Se utiliza por ejemplo en Medicina en la Respiración asistida de los pacientes; en todos los hospitales encontraremos grandes depósitos de oxígeno líquido. Además, es esencial en el proceso de combustión de azúcares mediante el cual la mayor parte de los seres vivos obtienen energía:
La mayor parte del oxígeno (80% de la producción mundial) se destina a la industria del hierro y del Acero (proceso Bessemer). Cada tonelada de acero necesita para su obtención de 3/4 tn de oxígeno. Otros usos:
- preparación de TiO2 a partir de TiCl4
- oxidación del NH3 en la fabricación de HNO3
- combustible (oxidante) en cohetes espaciales
- producción gas de síntesis (CO + H2O)
- oxidación directa de etileno a óxido de etileno
- fabricación de explosivos.
Bioenergética celular
La concentración de oxígeno en la atmósfera de la Tierra actualmente es un producto de la evolución de un balance bioquímico- biofisiológico entre los animales, quienes consumen el oxígeno, y las plantas que lo generan por medio de la fotosíntesis. La atmósfera en los tiempos del origen de la vida, era notablemente reductora y carente de oxígeno, pues de haber existido éste, las primeras moléculas habrían sido destruidas por oxidación. La incorporación del oxígeno al medio fue lenta y progresiva; y esto facilitó el desarrollo de la vida. Así, los organismos vivos pasaron de una respiración anaerobia a una aerobia que permitió la síntesis de mayor número de moléculas de ATP; sin esta energía no hay vida orgánica, vegetal, animal, ni humana. El solo hecho de estar vivo condiciona determinadas necesidades de energía (ergosia) que son característicos de la etapa del ciclo vital de que se trate, y de no ser satisfechas debidamente, terminan incrementando el riesgo de enfermar en un lapso más o menos largo. El sostén alimentario del estado nutricional es una parte inseparable de la vida, de su duración y calidad. Como la enfermedad en general aumenta los requerimientos metabólicos, la alimentación adecuada se torna un factor indispensable de todo procedimiento terapéutico. La acción efectiva sobre una insuficiencia de oxígeno, ya desarrollada o su prevención, debe ser una constante alerta para el médico actual, con el objetivo de modificar favorablemente el curso de un sinnúmero de enfermedades; y en este sentido el papel de la oxigenación hiperbárica (OHB) debe ser considerado.
Véase también
Enlaces externos
- Filtro de oxigeno, respira mejor
- Generadores de Ozono
- Análisis de los elementos de la Tabla Periódica
- Oxígeno
- El ozono, O3
- Oxigeno
- OXIGENO
- PROPIEDADES PARTICULARES DEL OXIGENO SEGUN RENE JACQUIER
- Relaciones energéticas en química
- Tabla periódica de los Elementos
Fuentes
- Frédéric Guérin, En busca de las partículas elementales, Diario del CNRS, 1984.
- Grignard Victor, Compendio de Química Orgánica, Ed. Masson, 1958
- Jacquier R., Del átomo a la vida, 441 pp., Ed. Amphora, 1961.
- Jacquier R., Ensayo sobre una mecánica universal, 1981, 214 pp., Imp. Corbasienne – Rhône
- Jumber, Oxígeno, curso de física, academia de Nancy-Metz.
- Karrer, Tratado de química orgánica, Edition du Griffon, 965p., 1946