Diferencia entre revisiones de «Metales de transición»
| Línea 1: | Línea 1: | ||
| − | <div align="justify"> | + | <div align="justify"> |
| − | |||
{{Definición | {{Definición | ||
|nombre= Metales de transición | |nombre= Metales de transición | ||
| − | |imagen= | + | |imagen=Metales_trans.jpg |
|tamaño= | |tamaño= | ||
| − | |concepto= Elementos químicos que están situados en la parte central del sistema periódico, en el bloque d, cuya principal característica es la inclusión en su configuración electrónica del orbital d, parcialmente lleno de electrones.}} '''Metales de | + | |concepto= Elementos químicos que están situados en la parte central del sistema periódico, en el bloque d, cuya principal característica es la inclusión en su configuración electrónica del orbital d, parcialmente lleno de electrones.}} |
| + | '''Metales de transición o elementos de transición.''' La IUPAC define un metal de transición como "un elemento cuyo [[Átomo|átomo]] tiene una subcapa d incompleta o que puede dar lugar a cationes con una subcapa d incompleta". El zinc, cadmio, y mercurio están excluidos de estos elementos. | ||
| − | == Elementos== | + | |
| + | ==Origen del nombre== | ||
| + | |||
| + | El nombre de "transición" proviene de una característica que presentan estos elementos de poder ser estables por si mismos sin necesidad de una reacción con otro elemento. Cuando a su última capa de valencia le | ||
| + | faltan electrones para estar completa, los extrae de capas internas. | ||
| + | |||
| + | Con eso es estable, pero le faltarían electrones en la capa donde los extrajo, así que los completa con otros electrones propios de otra capa. Y así sucesivamente; este fenómeno se le llama "[[Transición | ||
| + | electrónica|Transición electrónica]]". | ||
| + | |||
| + | Esto también tiene que ver con que estos elementos sean tan estables y difíciles de hacer reaccionar con otros. La definición más amplia es la que tradicionalmente se ha utilizado. Sin embargo muchas propiedades | ||
| + | interesantes de los elementos de transición como grupo son el resultado de su subcapa d parcialmente completa. | ||
| + | |||
| + | Las tendencias periódicas del bloque d son menos predominantes que en el resto de la tabla periódica. A través de esta la valencia no cambia porque los electrones adicionados al átomo van a capas internas.<br> | ||
| + | |||
| + | === Elementos excluídos === | ||
| + | |||
| + | El [[Zinc|zinc]], [[Cadmio|cadmio]], y [[Mercurio (Elemento)|mercurio]] están excluidos de los [[Metales de transición|metales de transición]], ya que tienen una configuración d10. | ||
| + | |||
| + | Solo se forman unas pocas especies transitorias de estos elementos que dan lugar a [[Iones|iones]] con una subcapa d parcialmente completa. Por ejemplo [[Mercurio|mercurio]] (I) solo se encuentra como Hg22+, el cual no forma un ion aislado con una subcapa parcialmente llena, por lo que los tres elementos son inconsistentes con la definición anterior. | ||
| + | |||
| + | Estos forman iones con estado de oxidación 2+, pero conservan la configuración 4d10. El elemento 112 podría también ser excluido aunque sus propiedades de oxidación no son observadas debido a su naturaleza radioactiva. Esta definición corresponde a los grupos 3 a 11 de la [[Tabla periódica de 34 columnas|tabla periódica]]. Según la definición más amplia los [[Metales_de_trancisión|metales de transición]] son los cuarenta elementos químicos, del 21 al 30, del 39 al 48, del 71 al 80 y del 103 al 112. | ||
| + | |||
| + | |||
| + | == Elementos químicos== | ||
En la tabla periódica, los elementos químicos también pueden ser clasificados en conjuntos, llamados series químicas, de acuerdo con su configuración electrónica. | En la tabla periódica, los elementos químicos también pueden ser clasificados en conjuntos, llamados series químicas, de acuerdo con su configuración electrónica. | ||
| − | • Elementos representativos:pertenecientes a los grupos 1, 2 y dos grupos de 13 a 17. | + | • Elementos representativos: pertenecientes a los grupos 1, 2 y dos grupos de 13 a 17. |
[[Image:Metales de trans.png|left]]• '''Elementos (o metales) de transición:''' pertenecientes a los grupos de 3 a 12. | [[Image:Metales de trans.png|left]]• '''Elementos (o metales) de transición:''' pertenecientes a los grupos de 3 a 12. | ||
| Línea 17: | Línea 40: | ||
• Elementos (o metales) de transición interna:pertenecientes a las series de los lantánidos y de los actínidos. | • Elementos (o metales) de transición interna:pertenecientes a las series de los lantánidos y de los actínidos. | ||
| − | • Gases nobles:pertenecientes al grupo 18. | + | • Gases nobles: pertenecientes al grupo 18. |
Además de esto, podemos clasificar los elementos de acuerdo con sus propiedades físicas en los siguientes grupos: | Además de esto, podemos clasificar los elementos de acuerdo con sus propiedades físicas en los siguientes grupos: | ||
| − | Metales:Ellos constituyen la mayoría de los elementos de la tabla. Son buenos conductores de electricidad y calor, son maleables y dúctiles, poseen brillo metálico característico y son sólidos, con excepción del mercurio. | + | * Metales: Ellos constituyen la mayoría de los elementos de la tabla. Son buenos conductores de electricidad y calor, son maleables y dúctiles, poseen brillo metálico característico y son sólidos, con excepción del mercurio. |
| + | |||
| + | * No metales: Son los más abundantes en la naturaleza y al contrario de los metales, no son buenos conductores de calor y electricidad, no son maleables y dúctiles y no poseen brillo. | ||
| − | + | * Gases nobles: Son en total 6 elementos y su característica más importante es la inercia química. | |
| − | + | * Hidrógeno: El hidrógeno es un elemento considerado aparte por tener un comportamiento único entre los demás elementos. | |
| − | + | === Propiedades<br> === | |
| − | + | Casi todos son metales típicos, de elevada dureza, con puntos de fusión y ebullición altos, buenos [[Conductores|conductores]] tanto del calor como de la electricidad. Muchas de las propiedades de los metales de transición se deben a la capacidad de los electrones del orbital d de localizarse dentro de la red metálica. | |
| − | + | En metales, cuanto más electrones compartan un núcleo, más fuerte es el metal. Poseen una gran versatilidad de estados de oxidación, pudiendo alcanzar una carga positiva tan alta como la de su grupo, e incluso en ocasiones negativa (Como en algunos complejos de coordinación).<br> | |
*Sus combinaciones son fuertemente coloreadas y paramagnéticas | *Sus combinaciones son fuertemente coloreadas y paramagnéticas | ||
| Línea 42: | Línea 67: | ||
== Estados de oxidación variables<br> == | == Estados de oxidación variables<br> == | ||
| − | A diferencia de los metales de los grupos 1 y 2, los | + | A diferencia de los metales de los grupos 1 y 2, los iones de los elementos de transición pueden tener múltiples estados de oxidación estables ya que pueden perder electrones d sin un gran sacrificio energético. |
| + | |||
| + | El [[Manganeso|manganeso]], por ejemplo tiene dos [[Electrones|electrones]] 4s y cinco 3d que pueden ser eliminados. La pérdida de todos estos electrones lleva a un estado de oxidación +7. El osmio y el rutenio se encuentran comúnmente solos en un estado de oxidación +8 muy estable el cual es uno de los más elevados para compuestos aislados.<br> | ||
| + | |||
| + | ===Patrones en los estados de oxidación === | ||
| + | |||
| + | *El número de estados de oxidación aumenta para cada ion hasta el Mn, a partir del cual comienza a disminuir. | ||
| − | + | Los últimos metales de transición tienen una mayor atracción entre los protones y electrones (ya que hay más de cada uno presentes), lo que requeriría más energía para eliminar los electrones.<br> | |
| − | + | *Cuando los elementos están en estados de oxidación bajos, se pueden encontrar como iones simples. Sin embargo, los metales de transición en estados de oxidación elevados se encuentran generalmente unidos covalentemente a elementos electronegativos como [[Oxígeno|oxígeno]] o [[Flúor (Elemento Químico)|flúor]] formando iones poliatómicos como el cromato, vanadato, o permanganato.<br> | |
| − | *Cuando los elementos están en estados de oxidación bajos, se pueden encontrar como iones simples. Sin embargo, los metales de transición en estados de oxidación elevados se encuentran generalmente unidos covalentemente a elementos electronegativos como [[Oxígeno|oxígeno]] o [[Flúor (Elemento Químico)|flúor]] formando iones poliatómicos como el | ||
| − | === | + | ==== Estabilidad de los estados de oxidación==== |
| − | * | + | *Iones en elevados estados de oxidación tienden a ser buenos agentes oxidantes, mientras que elementos en bajos estados de oxidación tienden a ser buenos agentes reductores.<br> |
*Iones 2+ a través del periodo comienzan como fuertes reductores y se vuelven más estables.<br> | *Iones 2+ a través del periodo comienzan como fuertes reductores y se vuelven más estables.<br> | ||
*Iones 3+ comienzan estables y se vuelven más oxidantes a través del periodo. | *Iones 3+ comienzan estables y se vuelven más oxidantes a través del periodo. | ||
| Línea 57: | Línea 87: | ||
== Actividad catalítica<br> == | == Actividad catalítica<br> == | ||
| − | Los | + | Los metales de transición forman buenos catalizadores homogéneos y heterogéneos, por ejemplo el hierro es el catalizador para el proceso de Haber y tanto el [[Níquel|níquel]] como el platino son utilizados para la hidrogenación de alquenos. Esto es porque son capaces de reaccionar bajo numerosos estados de oxidación y como consecuencia de ello formar nuevos compuestos proveyendo una ruta de reacción alternativa con una energía de activación más baja.<br> |
== Compuestos coloreados<br> == | == Compuestos coloreados<br> == | ||
| Línea 63: | Línea 93: | ||
Debido a su estructura, los metales de transición forman muchos iones y complejos coloreados. Los colores pueden cambiar entre diferentes iones de un mismo elemento. Por ejemplo el MnO4− (Mn en el estado de oxidación 7+) es un compuesto violeta, mientras que Mn2+ es rosado pálido. | Debido a su estructura, los metales de transición forman muchos iones y complejos coloreados. Los colores pueden cambiar entre diferentes iones de un mismo elemento. Por ejemplo el MnO4− (Mn en el estado de oxidación 7+) es un compuesto violeta, mientras que Mn2+ es rosado pálido. | ||
| − | La coordinación por ligandos puede jugar su parte en determinar el color en un compuesto de transición debido a cambios en la energía de los orbitales d. Los ligandos eliminan la degeneración de los orbitales y los dividen en grupos de alta y baja energía. La diferencia de energía entre los orbitales de alta y baja energía determinará el color de la luz que es absorbida, ya que la radiación electromagnética se absorbe si tiene una energía que se corresponda con esta diferencia. Cuando un ion con ligandos absorbe luz algunos electrones son promovidos a un orbital de mayor energía. Si la luz absorbida es de diferente frecuencia, se observan diferentes colores. | + | La coordinación por ligandos puede jugar su parte en determinar el color en un compuesto de transición debido a cambios en la energía de los orbitales d. |
| + | |||
| + | Los ligandos eliminan la degeneración de los orbitales y los dividen en grupos de alta y baja energía. La diferencia de energía entre los orbitales de alta y baja energía determinará el color de la luz que es absorbida, ya que la radiación electromagnética se absorbe si tiene una energía que se corresponda con esta diferencia. | ||
| + | |||
| + | Cuando un ion con ligandos absorbe luz algunos electrones son promovidos a un orbital de mayor energía. Si la luz absorbida es de diferente frecuencia, se observan diferentes colores. | ||
=== Color de un complejo === | === Color de un complejo === | ||
| Línea 82: | Línea 116: | ||
*[http://www.iupac.org International Union of Pure and Applied Chemistry] | *[http://www.iupac.org International Union of Pure and Applied Chemistry] | ||
| − | *Cotton, F. | + | *Cotton, F. A, Wilkinson, G. y Murillo, C. A. (1999). Advanced Inorganic Chemistry (6th ed.). New York: Wiley. ISBN 0-471-19957-5 |
| − | *Matsumoto, | + | *Matsumoto, S. (2005). Trends in Ionization Energy of Transition-Metal Elements J. Chem. Educ. |
[[Category:Química_inorgánica]] [[Category:Metales]] | [[Category:Química_inorgánica]] [[Category:Metales]] | ||
Revisión del 13:41 11 jul 2011
Metales de transición o elementos de transición. La IUPAC define un metal de transición como "un elemento cuyo átomo tiene una subcapa d incompleta o que puede dar lugar a cationes con una subcapa d incompleta". El zinc, cadmio, y mercurio están excluidos de estos elementos.
Sumario
Origen del nombre
El nombre de "transición" proviene de una característica que presentan estos elementos de poder ser estables por si mismos sin necesidad de una reacción con otro elemento. Cuando a su última capa de valencia le faltan electrones para estar completa, los extrae de capas internas.
Con eso es estable, pero le faltarían electrones en la capa donde los extrajo, así que los completa con otros electrones propios de otra capa. Y así sucesivamente; este fenómeno se le llama "[[Transición electrónica|Transición electrónica]]".
Esto también tiene que ver con que estos elementos sean tan estables y difíciles de hacer reaccionar con otros. La definición más amplia es la que tradicionalmente se ha utilizado. Sin embargo muchas propiedades interesantes de los elementos de transición como grupo son el resultado de su subcapa d parcialmente completa.
Las tendencias periódicas del bloque d son menos predominantes que en el resto de la tabla periódica. A través de esta la valencia no cambia porque los electrones adicionados al átomo van a capas internas.
Elementos excluídos
El zinc, cadmio, y mercurio están excluidos de los metales de transición, ya que tienen una configuración d10.
Solo se forman unas pocas especies transitorias de estos elementos que dan lugar a iones con una subcapa d parcialmente completa. Por ejemplo mercurio (I) solo se encuentra como Hg22+, el cual no forma un ion aislado con una subcapa parcialmente llena, por lo que los tres elementos son inconsistentes con la definición anterior.
Estos forman iones con estado de oxidación 2+, pero conservan la configuración 4d10. El elemento 112 podría también ser excluido aunque sus propiedades de oxidación no son observadas debido a su naturaleza radioactiva. Esta definición corresponde a los grupos 3 a 11 de la tabla periódica. Según la definición más amplia los metales de transición son los cuarenta elementos químicos, del 21 al 30, del 39 al 48, del 71 al 80 y del 103 al 112.
Elementos químicos
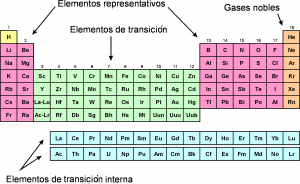
En la tabla periódica, los elementos químicos también pueden ser clasificados en conjuntos, llamados series químicas, de acuerdo con su configuración electrónica.
• Elementos representativos: pertenecientes a los grupos 1, 2 y dos grupos de 13 a 17.
• Elementos (o metales) de transición: pertenecientes a los grupos de 3 a 12.• Elementos (o metales) de transición interna:pertenecientes a las series de los lantánidos y de los actínidos.
• Gases nobles: pertenecientes al grupo 18.
Además de esto, podemos clasificar los elementos de acuerdo con sus propiedades físicas en los siguientes grupos:
- Metales: Ellos constituyen la mayoría de los elementos de la tabla. Son buenos conductores de electricidad y calor, son maleables y dúctiles, poseen brillo metálico característico y son sólidos, con excepción del mercurio.
- No metales: Son los más abundantes en la naturaleza y al contrario de los metales, no son buenos conductores de calor y electricidad, no son maleables y dúctiles y no poseen brillo.
- Gases nobles: Son en total 6 elementos y su característica más importante es la inercia química.
- Hidrógeno: El hidrógeno es un elemento considerado aparte por tener un comportamiento único entre los demás elementos.
Propiedades
Casi todos son metales típicos, de elevada dureza, con puntos de fusión y ebullición altos, buenos conductores tanto del calor como de la electricidad. Muchas de las propiedades de los metales de transición se deben a la capacidad de los electrones del orbital d de localizarse dentro de la red metálica.
En metales, cuanto más electrones compartan un núcleo, más fuerte es el metal. Poseen una gran versatilidad de estados de oxidación, pudiendo alcanzar una carga positiva tan alta como la de su grupo, e incluso en ocasiones negativa (Como en algunos complejos de coordinación).
- Sus combinaciones son fuertemente coloreadas y paramagnéticas
- Sus potenciales normales suelen ser menos negativos que los de los metales representativos, estando entre ellos los llamados metales nobles.
- Pueden formar aleaciones entre ellos.
- Son en general buenos catalizadores.
- Son sólidos a temperatura ambiente (excepto el mercurio)
- Forman complejos iónicos.
Estados de oxidación variables
A diferencia de los metales de los grupos 1 y 2, los iones de los elementos de transición pueden tener múltiples estados de oxidación estables ya que pueden perder electrones d sin un gran sacrificio energético.
El manganeso, por ejemplo tiene dos electrones 4s y cinco 3d que pueden ser eliminados. La pérdida de todos estos electrones lleva a un estado de oxidación +7. El osmio y el rutenio se encuentran comúnmente solos en un estado de oxidación +8 muy estable el cual es uno de los más elevados para compuestos aislados.
Patrones en los estados de oxidación
- El número de estados de oxidación aumenta para cada ion hasta el Mn, a partir del cual comienza a disminuir.
Los últimos metales de transición tienen una mayor atracción entre los protones y electrones (ya que hay más de cada uno presentes), lo que requeriría más energía para eliminar los electrones.
- Cuando los elementos están en estados de oxidación bajos, se pueden encontrar como iones simples. Sin embargo, los metales de transición en estados de oxidación elevados se encuentran generalmente unidos covalentemente a elementos electronegativos como oxígeno o flúor formando iones poliatómicos como el cromato, vanadato, o permanganato.
Estabilidad de los estados de oxidación
- Iones en elevados estados de oxidación tienden a ser buenos agentes oxidantes, mientras que elementos en bajos estados de oxidación tienden a ser buenos agentes reductores.
- Iones 2+ a través del periodo comienzan como fuertes reductores y se vuelven más estables.
- Iones 3+ comienzan estables y se vuelven más oxidantes a través del periodo.
Actividad catalítica
Los metales de transición forman buenos catalizadores homogéneos y heterogéneos, por ejemplo el hierro es el catalizador para el proceso de Haber y tanto el níquel como el platino son utilizados para la hidrogenación de alquenos. Esto es porque son capaces de reaccionar bajo numerosos estados de oxidación y como consecuencia de ello formar nuevos compuestos proveyendo una ruta de reacción alternativa con una energía de activación más baja.
Compuestos coloreados
Debido a su estructura, los metales de transición forman muchos iones y complejos coloreados. Los colores pueden cambiar entre diferentes iones de un mismo elemento. Por ejemplo el MnO4− (Mn en el estado de oxidación 7+) es un compuesto violeta, mientras que Mn2+ es rosado pálido.
La coordinación por ligandos puede jugar su parte en determinar el color en un compuesto de transición debido a cambios en la energía de los orbitales d.
Los ligandos eliminan la degeneración de los orbitales y los dividen en grupos de alta y baja energía. La diferencia de energía entre los orbitales de alta y baja energía determinará el color de la luz que es absorbida, ya que la radiación electromagnética se absorbe si tiene una energía que se corresponda con esta diferencia.
Cuando un ion con ligandos absorbe luz algunos electrones son promovidos a un orbital de mayor energía. Si la luz absorbida es de diferente frecuencia, se observan diferentes colores.
Color de un complejo
Esta característica depende de:
- La naturaleza del ion metálico, particularmente el número de electrones en los orbitales d
- El orden de los ligandos alrededor del ion metálico (por ejemplo, diferentes isómeros geométricos pueden mostrar diferentes colores)
- La naturaleza de los ligandos rodeando al ion metálico. Si los ligandos son más fuertes, es mayor la diferencia de energía entre los grupos 3d.
El complejo formado por el elemento zinc del bloque d (aunque no es estrictamente un elemento de transición) es incoloro, porque los orbitales 3d están completos y los electrones no son capaces de desplazarse al grupo superior.
Véase también
Fuentes
- International Union of Pure and Applied Chemistry
- Cotton, F. A, Wilkinson, G. y Murillo, C. A. (1999). Advanced Inorganic Chemistry (6th ed.). New York: Wiley. ISBN 0-471-19957-5
- Matsumoto, S. (2005). Trends in Ionization Energy of Transition-Metal Elements J. Chem. Educ.