Diferencia entre revisiones de «Hidruros»
(→Hidruros de los metales) |
|||
| (No se muestran 8 ediciones intermedias de 6 usuarios) | |||
| Línea 1: | Línea 1: | ||
| − | |||
| − | |||
{{Definición | {{Definición | ||
|nombre=Hidruros | |nombre=Hidruros | ||
| − | |imagen= | + | |imagen=Hidruros.jpeg |
|tamaño= | |tamaño= | ||
|concepto= Compuestos binarios formados por átomos de [[hidrógeno]] y de otro elemento (pudiendo ser este, metal o no metal) | |concepto= Compuestos binarios formados por átomos de [[hidrógeno]] y de otro elemento (pudiendo ser este, metal o no metal) | ||
| − | }} | + | }}<div align=justify> |
| − | + | '''Hidruros'''. Existen dos tipos de hidruros: los [[Hidruros metálicos|metálicos]] y los [[hidrácidos]]. | |
| − | |||
==Estado de oxidación== | ==Estado de oxidación== | ||
| Línea 16: | Línea 13: | ||
== Hidruros de los no metales de carácter ácido == | == Hidruros de los no metales de carácter ácido == | ||
| − | * Se | + | * Se formulan escribiendo primero el símbolo del hidrógeno y después el del elemento. A continuación se intercambian las [[Valencia (química) | valencias]]. Los elementos como el [[azufre]], [[selenio]] y [[telurio]] se combinan con el hidrógeno con valencia 2, y los elementos como el [[flúor]], [[cloro]], [[bromo]] y [[yodo]], con valencia 1. |
| − | * Se | + | * Se nombran añadiendo la terminación uro en la raíz del nombre del '''no-metal''' y especificando, a continuación, de hidrógeno: |
| − | HF → flúor | + | HF → flúor uro de hidrógeno |
| − | HCl → clor | + | HCl → clor uro de hidrógeno |
| − | HBr → brom | + | HBr → brom uro de hidrógeno |
| − | HI → yod | + | HI → yod uro de hidrógeno |
| − | H<sub>2</sub>S → sulf | + | H<sub>2</sub>S → sulf uro de hidrógeno |
| − | H<sub>2</sub>Se → selen | + | H<sub>2</sub>Se → selen uro de hidrógeno |
| − | H<sub>2</sub>Te → telel | + | H<sub>2</sub>Te → telel uro de hidrógeno |
=== Otros hidruros de no metales === | === Otros hidruros de no metales === | ||
| − | * Se | + | *Se formulan indicando primero el símbolo del elemento y luego el del hidrógeno. A continuación, se intercambian las valencias. |
| − | * Todos estos compuestos reciben | + | *Todos estos compuestos reciben nombres tradicionales admitidos por la IUPAC, y son los que habitualmente utilizan los químicos. Los más importantes son: |
| − | NH <sub>3</sub> → | + | NH <sub>3</sub> →[[amoníaco ]] |
| − | CH<sub>4</sub> → | + | CH<sub>4</sub> →[[metano]] |
== Hidruros de los metales == | == Hidruros de los metales == | ||
| − | * Se | + | * Se formulan escribiendo primero el símbolo del elemento metálico |
| − | * Se | + | * Se nombran con la palabra hidruro seguida del nombre de metal. |
''Ejemplo:'' | ''Ejemplo:'' | ||
| − | LiH → | + | LiH → hidruro de litio |
| − | CaH<sub>2</sub> → | + | CaH<sub>2</sub> → hidruro de calcio |
| − | SrH<sub>2</sub> → | + | SrH<sub>2</sub> → hidruro de estroncio |
| − | + | '''Hidruros metálicos''' | |
| − | + | Son el resultado de la unión entre el hidrógeno y un elemento metálico | |
| − | + | metal + hidrógeno = hidruro metálico | |
| − | + | 2Li + H<sub>2</sub> ------ 2LiH | |
| − | Los hidruros metálicos se caracterizan por ser los únicos [[ | + | Los hidruros metálicos se caracterizan por ser los únicos [[Compuesto químico|compuestos]] en los que el hidrogeno funciona como numero de oxidación de 1-. para escribir la formula de un hidruro metálico primero se escribe el símbolo del elemento metálico (parte positiva) y después el de hidrogeno (parte negativa). Por ejemplo, la formula de hidruro que resulta al combinarse el [[calcio]] con el [[hidrógeno]] es la siguiente: |
| − | + | *Ca<sup>2+</sup> | |
| + | *H<sup>1-</sup> | ||
para nombrarlos se utiliza la palabra hidruro, la preposición de y el nombre del elemento metálico. en el sistema de ginebra se utiliza las terminaciones –ico y -oso para indicar el mayor y el menor número de oxidación del elemento metálico, respectivamente; en el sistema de UIQPA esos son números se señalan con números del hidruro es el mismo en ambos sistemas. | para nombrarlos se utiliza la palabra hidruro, la preposición de y el nombre del elemento metálico. en el sistema de ginebra se utiliza las terminaciones –ico y -oso para indicar el mayor y el menor número de oxidación del elemento metálico, respectivamente; en el sistema de UIQPA esos son números se señalan con números del hidruro es el mismo en ambos sistemas. | ||
| Línea 72: | Línea 70: | ||
== Fuentes == | == Fuentes == | ||
| − | * Enciclopedia Encarta 2000 | + | * Enciclopedia Encarta [[2000]] |
| − | |||
* Babor, Joseph A. y Aznárez, José Ibarz. Química General Moderna. Instituto Cubano del libro. La Habana. [[1969]]. | * Babor, Joseph A. y Aznárez, José Ibarz. Química General Moderna. Instituto Cubano del libro. La Habana. [[1969]]. | ||
| − | + | * Artículo: [http://es.wikipedia.org/w/index.php?title=Hidruro Hidruro]. Consultado: 24 de septiembre de 2012. | |
| − | * http://es.wikipedia.org/w/index.php?title=Hidruro | + | * Plane, Robert A. y Sienko, Michel J. Química. ''Colección Ciencia Técnica Aguiar''. |
| − | |||
| − | * Plane, Robert A. y Sienko, Michel J. Química. Colección Ciencia Técnica Aguiar. | ||
| − | [[Categoría: | + | [[Category:Química]][[Categoría:Hidruros]] |
última versión al 16:15 6 ene 2014
| ||||||
Hidruros. Existen dos tipos de hidruros: los metálicos y los hidrácidos.
Sumario
Estado de oxidación
En un hidruro el estado de oxidación del Hidrógeno es -1
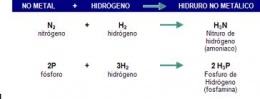
Hidruros de los no metales de carácter ácido
- Se formulan escribiendo primero el símbolo del hidrógeno y después el del elemento. A continuación se intercambian las valencias. Los elementos como el azufre, selenio y telurio se combinan con el hidrógeno con valencia 2, y los elementos como el flúor, cloro, bromo y yodo, con valencia 1.
- Se nombran añadiendo la terminación uro en la raíz del nombre del no-metal y especificando, a continuación, de hidrógeno:
HF → flúor uro de hidrógeno
HCl → clor uro de hidrógeno
HBr → brom uro de hidrógeno
HI → yod uro de hidrógeno
H2S → sulf uro de hidrógeno
H2Se → selen uro de hidrógeno
H2Te → telel uro de hidrógeno
Otros hidruros de no metales
- Se formulan indicando primero el símbolo del elemento y luego el del hidrógeno. A continuación, se intercambian las valencias.
- Todos estos compuestos reciben nombres tradicionales admitidos por la IUPAC, y son los que habitualmente utilizan los químicos. Los más importantes son:
NH 3 →amoníaco
CH4 →metano
Hidruros de los metales
- Se formulan escribiendo primero el símbolo del elemento metálico
- Se nombran con la palabra hidruro seguida del nombre de metal.
Ejemplo:
LiH → hidruro de litio
CaH2 → hidruro de calcio
SrH2 → hidruro de estroncio
Hidruros metálicos
Son el resultado de la unión entre el hidrógeno y un elemento metálico
metal + hidrógeno = hidruro metálico 2Li + H2 ------ 2LiH Los hidruros metálicos se caracterizan por ser los únicos compuestos en los que el hidrogeno funciona como numero de oxidación de 1-. para escribir la formula de un hidruro metálico primero se escribe el símbolo del elemento metálico (parte positiva) y después el de hidrogeno (parte negativa). Por ejemplo, la formula de hidruro que resulta al combinarse el calcio con el hidrógeno es la siguiente:
- Ca2+
- H1-
para nombrarlos se utiliza la palabra hidruro, la preposición de y el nombre del elemento metálico. en el sistema de ginebra se utiliza las terminaciones –ico y -oso para indicar el mayor y el menor número de oxidación del elemento metálico, respectivamente; en el sistema de UIQPA esos son números se señalan con números del hidruro es el mismo en ambos sistemas.