Diferencia entre revisiones de «Óxido»
(Página creada con '{{Desarrollo}} {{Definición|Nombre=Óxidos|imagen=oxido_plantilla.JPG|concepto=Son combinaciones binarias de un metal con el Oxígeno, en las que el oxígeno tiene número ...') |
|||
| Línea 7: | Línea 7: | ||
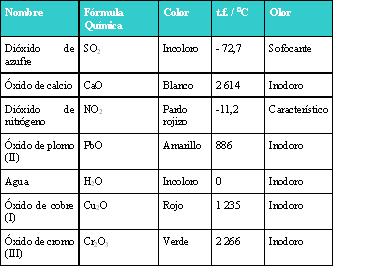
Las propiedades físicas de los óxidos son extraordinariamente variadas. Algunos son gaseosos a temperatura ambiente, como el dióxido de [[Carbono|carbono]], otros por el contrario son sólidos de elevadas temperaturas de fusión, como los óxidos de [[Magnesio|magnesio]] y de [[Calcio|calcio]], y otros líquidos a temperatura ambiente como el [[Agua|agua]]. El color, la solubilidad y el color varían de un óxido a otro. Ejemplos | Las propiedades físicas de los óxidos son extraordinariamente variadas. Algunos son gaseosos a temperatura ambiente, como el dióxido de [[Carbono|carbono]], otros por el contrario son sólidos de elevadas temperaturas de fusión, como los óxidos de [[Magnesio|magnesio]] y de [[Calcio|calcio]], y otros líquidos a temperatura ambiente como el [[Agua|agua]]. El color, la solubilidad y el color varían de un óxido a otro. Ejemplos | ||
| − | [[Image:Tabla 1oxidos.JPG|center|Tabla 1oxidos.JPG]]<br> | + | == [[Image:Tabla 1oxidos.JPG|center|Tabla 1oxidos.JPG]]Clasificación de los óxidos<br> == |
| + | |||
| + | <br> | ||
| + | |||
| + | *'''Óxidos Básicos''': Son formados por metales. El metal presente en su fórmula puede presentar “carga eléctrica” +1 y +2, o sea, poseer carácter iónico. Ejemplos son el Na<sub>2</sub>O (Óxido de sodio), BaO (Óxido de bario). | ||
| + | *'''Óxidos Neutros''': Son compuestos por no metales, ellos no reaccionan con agua, ácido o base en razón del enlace covalente que une sus componentes, de allí el porque de ser llamados óxidos inertes. Ejemplos son el monóxido de di nitrógeno (N<sub>2</sub>O) y monóxido de carbono (CO). | ||
| + | *'''Óxidos Ácidos''': También conocidos como anhídridos de ácidos, son formados por no metales y presentan carácter covalente. En la presencia de agua, producen ácidos y en la presencia de bases, origina sal y agua. Ejemplo de ello son el CO<sub>2</sub> (dióxido de carbono o gas carbono) y el SO<sub>2</sub> (dióxido de azufre) | ||
| + | *'''Óxidos Dobles o Mixtos''': La combinación de dos óxidos de un mismo elemento da origen a este tipo de óxidos. Ejemplo: magnetita (Fe<sub>2</sub>O<sub>4</sub>), unión de los óxidos de Hierro (Fe) y Oxígeno (O). Aplicaciones: Como imán natural. | ||
| + | *'''Óxidos anfóteros''': Presentan ambigüedad, en la presencia de un ácido se comportan como óxidos básicos y en la presencia de una base, como óxidos ácidos. Ejemplos son el óxido de aluminio (Al<sub>2</sub>O<sub>3</sub> ) y el óxido de zinc (ZnO). | ||
| + | *'''Peróxidos''': Compuestos que poseen en su fórmula el grupo (O<sub>2</sub>)<sup>2-</sup> . Ejemplos: Agua Oxigenada (H<sub>2</sub>O) y Peróxido de Sodio (Na<sub>2</sub>O<sub>2</sub>).Los peróxidos más comunes son formados por hidrógeno, metales alcalinos y metales alcalinos térreos. Son aplicados en la industria como blanqueadores de tejidos y pulpa de celulosa en la confección de papel.<br> | ||
| + | |||
| + | <br> | ||
| + | |||
| + | == Aplicaciones == | ||
| + | |||
| + | *La sílice (cuarzo), en sus múltiples variedades (ágata, amatista, ónice, cristal de roca, etc.), se emplea para fines ornamentales. Las arenas silíceas son materia prima para la fabricación de vidrio. El cuarzo se emplea para la fabricación de materiales de construcción (cemento, hormigón, etc.). | ||
| + | *Los óxidos de arsénico se usan en la industria del vidrio. También se emplean para la preparación de venenos, colorantes y productos agroquímicos. En Medicina se administran pequeñas dosis para ciertos tratamientos. | ||
| + | *El óxido de cobre rojo (cuprita) se añade a los vidrios para darles coloración roja. | ||
| + | *El óxido de magnesio (periclasa, magnesia calcinada) sirve para la preparación de carbonatos básicos de magnesio y de morteros resistentes al agua. Su uso mayoritario está en la fabricación de materiales refractarios. Se utilizan en la fabricación de abonos y en la preparación de medicamentos contra la acidez de estómago. Se usa como antídoto para muchos tipos de intoxicaciones. | ||
| + | *El óxido de cinc natural (cincita) se emplea el producto sintético, tanto para la fabricación de pinturas y colorantes, como para la preparación de pomadas antisépticas y productos de cosmética. | ||
| + | *Los óxidos de aluminio, además de ser mena de aluminio, son empleados como gemas (zafiro, rubí). El esmeril (variedad del corindón) se emplea para trabajar metales y aleaciones de gran dureza. En la industria cerámica se emplean bolas de alúmina para la molienda de cuarzos y feldespatos. | ||
| + | *Los óxidos de plomo son minerales raros y por lo tanto se emplean los obtenidos por síntesis. Se usan en la fabricación de vidrio (vidrio de calidad), en la fabricación de sales de plomo y colorantes diversos. | ||
| + | *Los óxidos de bismuto se usan como colorantes en pinturas y esmaltes. También sirven para la fabricación de vidrios de calidad óptica. | ||
| + | *Los óxidos de manganeso son menas de este metal. La pirolusita se usa como colorante en la industria del vidrio, pues al oxidarse a permanganato toma coloración violeta. El color violeta es complementario del amarillo y elimina tal coloración en los vidrios que contienen hierro Fe<sup>+3</sup>. También se emplea para la fabricación de pilas secas y en la obtención del cloro. | ||
| + | *El óxido mercúrico (montroidita), dada su rareza, no se usa en estado natural, si no que se obtiene artificialmente. Se utiliza en Medicina para la preparación de pomadas de uso oftalmológico y dermatológico. | ||
| + | |||
| + | <br> | ||
== Véase también == | == Véase también == | ||
| Línea 18: | Línea 44: | ||
*Libro de texto de [[Química]] (Parte1). [[Secundaria Básica]]. | *Libro de texto de [[Química]] (Parte1). [[Secundaria Básica]]. | ||
</div> | </div> | ||
| − | <br> | + | <br> |
[[Category:Soluciones]] | [[Category:Soluciones]] | ||
| + | |||
| + | <br> | ||
Revisión del 17:04 11 mar 2011
| ||||||
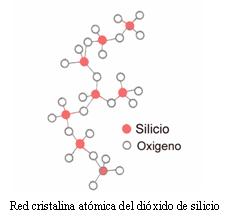
Óxidos. El dioxígeno reacciona con la mayoría de las sustancias simples formando compuestos binarios constituidos por el elemento Oxígeno y otro elemento metálico o no metálico. Entre esas sustancias se encuentran los óxidos. En la Naturaleza muchas de las sustancias conocidas son óxidos por ejemplo: el Dióxido de carbono, presente en el aire, el dióxido de silicio en forma de Sílice o Arena, y el Agua.
Sumario
Propiedades físicas de los óxidos
Las propiedades físicas de los óxidos son extraordinariamente variadas. Algunos son gaseosos a temperatura ambiente, como el dióxido de carbono, otros por el contrario son sólidos de elevadas temperaturas de fusión, como los óxidos de magnesio y de calcio, y otros líquidos a temperatura ambiente como el agua. El color, la solubilidad y el color varían de un óxido a otro. Ejemplos
Clasificación de los óxidos
- Óxidos Básicos: Son formados por metales. El metal presente en su fórmula puede presentar “carga eléctrica” +1 y +2, o sea, poseer carácter iónico. Ejemplos son el Na2O (Óxido de sodio), BaO (Óxido de bario).
- Óxidos Neutros: Son compuestos por no metales, ellos no reaccionan con agua, ácido o base en razón del enlace covalente que une sus componentes, de allí el porque de ser llamados óxidos inertes. Ejemplos son el monóxido de di nitrógeno (N2O) y monóxido de carbono (CO).
- Óxidos Ácidos: También conocidos como anhídridos de ácidos, son formados por no metales y presentan carácter covalente. En la presencia de agua, producen ácidos y en la presencia de bases, origina sal y agua. Ejemplo de ello son el CO2 (dióxido de carbono o gas carbono) y el SO2 (dióxido de azufre)
- Óxidos Dobles o Mixtos: La combinación de dos óxidos de un mismo elemento da origen a este tipo de óxidos. Ejemplo: magnetita (Fe2O4), unión de los óxidos de Hierro (Fe) y Oxígeno (O). Aplicaciones: Como imán natural.
- Óxidos anfóteros: Presentan ambigüedad, en la presencia de un ácido se comportan como óxidos básicos y en la presencia de una base, como óxidos ácidos. Ejemplos son el óxido de aluminio (Al2O3 ) y el óxido de zinc (ZnO).
- Peróxidos: Compuestos que poseen en su fórmula el grupo (O2)2- . Ejemplos: Agua Oxigenada (H2O) y Peróxido de Sodio (Na2O2).Los peróxidos más comunes son formados por hidrógeno, metales alcalinos y metales alcalinos térreos. Son aplicados en la industria como blanqueadores de tejidos y pulpa de celulosa en la confección de papel.
Aplicaciones
- La sílice (cuarzo), en sus múltiples variedades (ágata, amatista, ónice, cristal de roca, etc.), se emplea para fines ornamentales. Las arenas silíceas son materia prima para la fabricación de vidrio. El cuarzo se emplea para la fabricación de materiales de construcción (cemento, hormigón, etc.).
- Los óxidos de arsénico se usan en la industria del vidrio. También se emplean para la preparación de venenos, colorantes y productos agroquímicos. En Medicina se administran pequeñas dosis para ciertos tratamientos.
- El óxido de cobre rojo (cuprita) se añade a los vidrios para darles coloración roja.
- El óxido de magnesio (periclasa, magnesia calcinada) sirve para la preparación de carbonatos básicos de magnesio y de morteros resistentes al agua. Su uso mayoritario está en la fabricación de materiales refractarios. Se utilizan en la fabricación de abonos y en la preparación de medicamentos contra la acidez de estómago. Se usa como antídoto para muchos tipos de intoxicaciones.
- El óxido de cinc natural (cincita) se emplea el producto sintético, tanto para la fabricación de pinturas y colorantes, como para la preparación de pomadas antisépticas y productos de cosmética.
- Los óxidos de aluminio, además de ser mena de aluminio, son empleados como gemas (zafiro, rubí). El esmeril (variedad del corindón) se emplea para trabajar metales y aleaciones de gran dureza. En la industria cerámica se emplean bolas de alúmina para la molienda de cuarzos y feldespatos.
- Los óxidos de plomo son minerales raros y por lo tanto se emplean los obtenidos por síntesis. Se usan en la fabricación de vidrio (vidrio de calidad), en la fabricación de sales de plomo y colorantes diversos.
- Los óxidos de bismuto se usan como colorantes en pinturas y esmaltes. También sirven para la fabricación de vidrios de calidad óptica.
- Los óxidos de manganeso son menas de este metal. La pirolusita se usa como colorante en la industria del vidrio, pues al oxidarse a permanganato toma coloración violeta. El color violeta es complementario del amarillo y elimina tal coloración en los vidrios que contienen hierro Fe+3. También se emplea para la fabricación de pilas secas y en la obtención del cloro.
- El óxido mercúrico (montroidita), dada su rareza, no se usa en estado natural, si no que se obtiene artificialmente. Se utiliza en Medicina para la preparación de pomadas de uso oftalmológico y dermatológico.
Véase también
Fuentes
- óxidos
- Libro de texto de Química (Parte1). Secundaria Básica.